多重PCR法检测5种动物源性成分的适用性验证
2021-11-26 10:20:48 来源: 食品安全导刊
马慧娟,高 宏,牛鹏飞,梅 婵
(江苏省理化测试中心,江苏南京 210042)
摘 要:为了探索新建立的一种多重PCR对动物源性食品检测的适用性,实验采用猪、牛、羊、鸡和鸭肉混合的方法,用多重PCR对混合肉样进行检测,以验证多重PCR的检测的可行性和有效性。通过对市售20种样品提取DNA进行多重PCR和单一PCR的5种动物源性成分检测结果比对,进一步比较两种方法检测结果的不同。结果表明,建立的多重PCR可同时检测出2种、3种、4种和5种动物源性成分,采用多重PCR法和单一PCR法对20种市售样品分别检测,两种方法结果无差异,表明所建立的多重PCR法可检测猪、牛、羊、鸡和鸭5种动物源性成分。
关键词:动物源性食品;多重PCR;单一PCR;适用性
应用PCR方法检测食品中动物源性成分的研究和标准有很多,目前已颁布的国家标准、行业标准和地方标准主要是基于常规定性PCR法和实时荧光PCR法对单一动物源性成分的定性检测。在实际工作中,对于动物源性成分不明确的加工制品,在需明确其成分时,需要通过不同的方法进行多次检测才能确定结果,其周期长、工作量大、成本高。在未来的动物源成分检测中,基于常规定性PCR法的检测技术已经越来越不能满足多种动物源性制品的鉴定需求,因此建立多重PCR法提高检测的效率与通量对肉类食品安全的及时监管十分重要[1]。本研究通过对新建立的一种检测动物源性食品中猪、牛、羊、鸡和鸭成分的多重PCR法进行混合肉样检测,验证其方法的适用性和可行性,并用建立的多重PCR检测方法和单一PCR检测方法对市售的20种动物源性食品分别进行检测,验证多重PCR法鉴别猪、牛、羊、鸡和鸭成分可行性。
1 材料与方法
1.1 材料及试剂
鲜肉(猪、牛、羊、鸭、鸡)购自南京某大型菜市场,-20 ℃保存。加工肉制品(鸭血、牛肉卷、鸡肉火腿肠、午餐肉罐头等)购自南京某菜市场、超市或火锅食材店。
DNA提取试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver 5.0、10×PCR Buffer(Mg2+ plus)、dNTP Mixture(各2.5 mmol·L-1)、TaKaRa Taq(5 U/µL)、琼脂糖(50 g),均购于宝生物工程(大连)有限公司。
1.2 仪器和设备
ABI 2720普通PCR仪,购自美国赛默飞;EPS 300电泳仪,购自Tanon;Universal GenoSens1800凝胶成像仪,购自上海勤翔。
1.3 实验方法
1.3.1 样本DNA提取及质量检测
样本DNA的提取方法按照DNA提取试剂盒的说明书方法步骤进行。样本DNA提取后取DNA溶液1 µL,滴加到超微量紫外分光光度计中,测定DNA的质量浓度及纯度。DNA浓度控制在50~100 ng/µL,260nm/280nm值为1.8~2.1。
1.3.2 多重PCR方法检测混合样品
用所建立的方法对混合肉样进行PCR扩增,反应时加入2种、3种、4种、5种肉样的混合模板,按优化的引物浓度配比进行多重PCR检测,通过多次实验优化模板混合比例,以达到1个PCR反应和1次电泳可同时扩增出2~5条特异性条带,达到鉴别2~5种动物源性成分的目的。
1.3.3 市售动物源性食品检测
对从超市、菜市场和门店随机购买的20种肉制品,用建立的多重PCR检测方法和检测猪、牛、羊、鸡和鸭的行业标准[2-4]分别对猪、牛、羊、鸡和鸭5种成分进行检测,以检验建立的方法能否成功应用于市售肉类食品中的动物源性成分,进一步验证此方法的可行性。市售样品的DNA提取也同样按1.3.1的方法进行。
2 结果与分析
2.1 DNA质量浓度和纯度的检测结果
按照1.3.1对提取的样品DNA进行质量浓度及纯度测定,结果见表3。
由表1看出,用微量核酸蛋白测定分析仪检测提取的样品DNA的浓度和纯度,所测260nm/280nm值在1.8~2.1,有的DNA浓度提取的较高,需要对所提DNA的浓度进行适当稀释,从样品中提取的DNA无论是浓度还是纯度,均能满足后续PCR扩增实验的需求。

2.2 混合肉样品检测结果
分别以猪、牛、羊、鸡和鸭2种、3种、4种及5种肉样混合为混合模板,用建立的多重PCR检测方法进行多重PCR检测。结果见图1和图2。
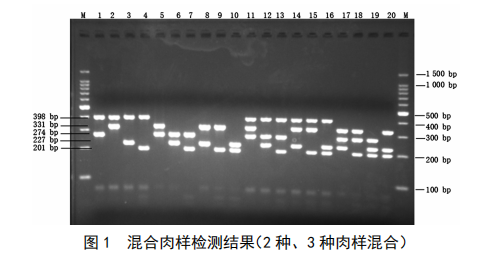
注:M.100 bp DNAladder;1. 猪 + 牛;2. 猪 + 羊;3. 猪 + 鸡;4. 猪+ 鸭;5. 牛 + 羊;6. 牛 + 鸡;7. 牛 + 鸭;8. 羊 + 鸡;9. 羊 + 鸭;10. 鸭+ 鸡;11. 猪 + 牛 + 羊;12. 猪 + 牛 + 鸡;13. 猪 + 牛 + 鸭;14. 猪 + 羊 +鸡;15.猪 +羊 +鸭;16.猪 +鸡 +鸭;17.牛 +羊 +鸡;18.牛 +羊 +鸭;19. 牛 + 鸡 + 鸭;20. 羊 + 鸡 + 鸭。
由图1可以看出,当猪和牛、猪和羊、猪和鸡、猪和鸭模板混合比例分别为1︰1、1︰1、1︰2、1︰2时,牛和羊、牛和鸡、牛和鸭模板混合比例分别为1︰1、1︰2、1︰2时,羊和鸡、羊和鸭、鸭和鸡模板混合比例分别为1︰2、1︰2、1︰1时,猪、牛和羊、猪、牛和鸡、猪、牛和鸭、猪、羊和鸡、猪、羊和鸭、猪、鸡和鸭、牛、羊和鸡、牛、羊和鸭、牛、鸡和鸭、羊、鸡和鸭模板混合比例分别为1︰1︰1、1︰1︰2、1︰1︰2、1︰1︰2、1︰1︰2、1︰2︰2、1︰1︰2、1︰1︰2、1︰2︰2、1︰2︰2时,能分别同时扩增出牛274 bp,羊331 bp,398 bp,鸡227 bp,鸭201 bp 2条或3条特异性条带。

注:M.100 bp DNAladder;1. 猪 + 羊 + 牛 + 鸡;2. 猪 + 羊 + 牛 +鸭;3. 猪 + 牛 + 鸡 + 鸭;4. 猪 + 羊 + 鸡 + 鸭;5. 牛 + 羊 + 鸡 + 鸭;6. 猪 + 牛 + 羊 + 鸡 + 鸭。
由图2可以看出,当猪、羊、牛和鸡、猪、羊、牛和鸭、猪、牛、鸡和鸭、猪、羊、鸡和鸭、牛、羊、鸡和鸭模板混合比例分别为1︰1︰1︰2、1︰1︰1︰2、1︰1︰2︰2、1︰1︰2︰2、1︰1︰2︰2时,猪、牛、羊、鸡和鸭模板混合比例1︰1︰1︰2︰2时,能分别同时扩增出牛274 bp,羊331 bp,398 bp,鸡227 bp,鸭201 bp 4条或5条特异性条带。以上的电泳条带清晰,亮度基本一样,能分别有效鉴别出2种、3种、4种或5种动物源性成分。
2.3 市售肉制品检测结果
对市售的20种肉制品进行DNA提取,应用建立的多重PCR方法和单一PCR分别进行检测,判断所检测成分与所贴标签是否相符,同时验证所建立方法的可行性和实用性。扩增结果见表2。
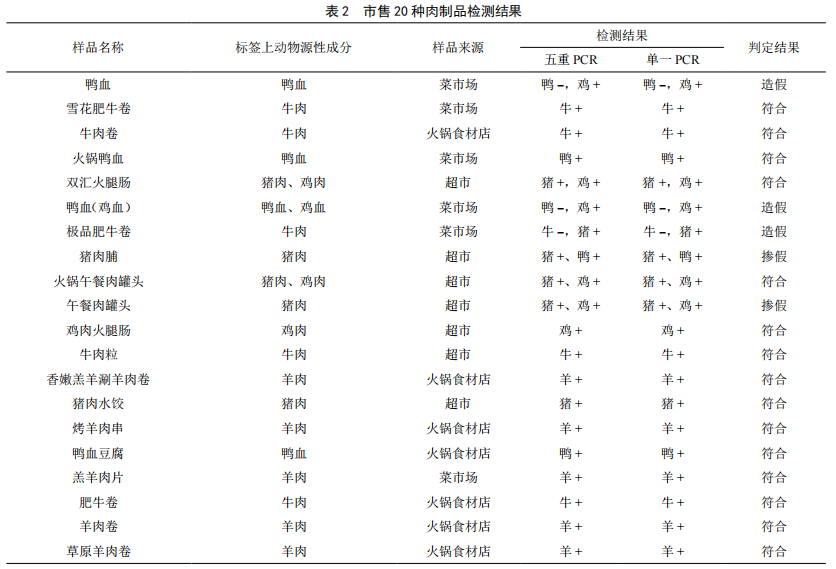
由表2看出,应用建立的五重PCR方法与用单一PCR对市售的20种肉制品分别进行猪、牛、羊、鸡和鸭成分进行检测,由检测结果对比可以看出,两种方法检测出的动物源性成分结果一致。使用混合引物对上述5种成分进行检测,检测结果能够扩增出来相应的多种肉的特异性条带,该检测方法能够准确地鉴定出所建立方法的5种常见动物成分,对于经过加工的肉制品,方法扩增出来的条带依然很清晰有效。本研究所鉴定的产品大多数与标签标识成分相符,但也存在造假和掺假的问题,所购买的样品掺假和造假率为25%。
3 讨论
本研究建立的多重PCR法可满足一次PCR反应和一次电泳就能分别有效鉴别出2种、3种、4种或5种动物源性成分,大大地减少了试剂和时间成本。为验证所建立方法的可行性和准确性,对市售的20种肉制品应用所建立的五重PCR和单一PCR对样品分别进行猪、牛、羊、鸡和鸭成分的检测,检测结果表明所建立的方法与单一PCR检测结果一致。表明所建立的多重PCR法可同时检测猪、牛、羊、鸡和鸭5种动物源性成分。本研究与王金斌等[1]研究的5种动物源性成分多重PCR检测方法相比,开发的方法引物数量少3条,与其相比,本研究使用的试剂更少,更加节约时间和成本。
参考文献
[1]王金斌,白蓝,李文,等.同步检测动物源性成分的五重PCR的条件优化和检出限分析[J].核农学报,2018,32(3):506-514.
[2]国家食品药品监督管理总局.SN/T 2051—2008食品、化妆品和饲料中牛羊猪源性成分检测方法实时PCR法[S].北京:中国标准出版社,2008.
[3]国家食品药品监督管理总局.SN/T 2978—2011动物源性产品中鸡源性成分PCR检测方法[S].北京:中国标准出版社,2012.
[4]国家食品药品监督管理总局.SN/T 3731.5—2013食品及饲料中常见禽类品种的鉴定方法第5部分:鸭成分检测PCR法[S].北京:中国标准出版社,2014.
基金项目:江苏省生产力促进中心青年人才基金项目“食品中牛、羊、猪、鸡、鸭源性成分多重PCR快速检测方法的建立”(Z2020009)。
作者简介:马慧娟(1988—),女,汉族,河南安阳人,硕士,工程师。研究方向:食品安全检测技术开发。
通信作者:高宏(1976—),男,汉族,江苏南京人,硕士,高级工程师。研究方向:食品质量安全检测技术。
热点推荐
-

使用梅特勒-托利多X光机的五大理由
-

小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金秋喜迎初丰收
-

全球食品创新平台第五期已启动,携手共创安全、健康、绿色的未来
-
特医食品不是药,却是临床治疗的关键支撑
-

“喂饱”体内的益生菌,肠道更健康
-

多重PCR法检测5种动物源性成分的适用性验证
-
还原剂浓度对氢化物原子荧光法测量饮用水中铅的影响
-
酱菜腌渍类食品亚硝酸盐含量的检测
-
气相色谱-三重四极杆质谱法测定辣椒中咪鲜胺及其代谢物残留量
-
液相色谱-原子荧光法测定水产食品中的甲基汞
-

利用HPLC内标法测定益生菌类保健食品中低聚木糖的含量
-
ATP生物荧光增幅法在食品微生物污染检测中的应用
-

高效液相色谱仪、酶标仪和快检仪检测小麦中呕吐毒素的对比分析
-
高效液相色谱法测定烤鱼中的苯并[α]芘
-
食品中霉菌检测方法的改进研究
-
超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量
-
不同前处理方法对蔬菜、水果农药残留GC-MS/MS检测结果的影响分析
-
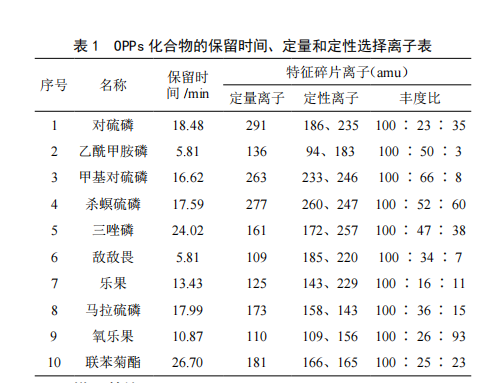
气相色谱-质谱联用法测定白花蛇舌草中10种有机磷农药残留量
-
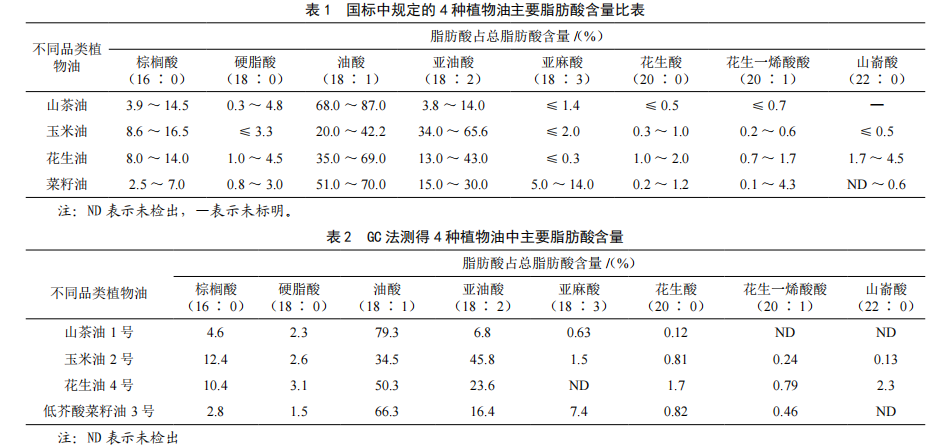
基于GC和GC-MS技术检测山茶油掺伪
-
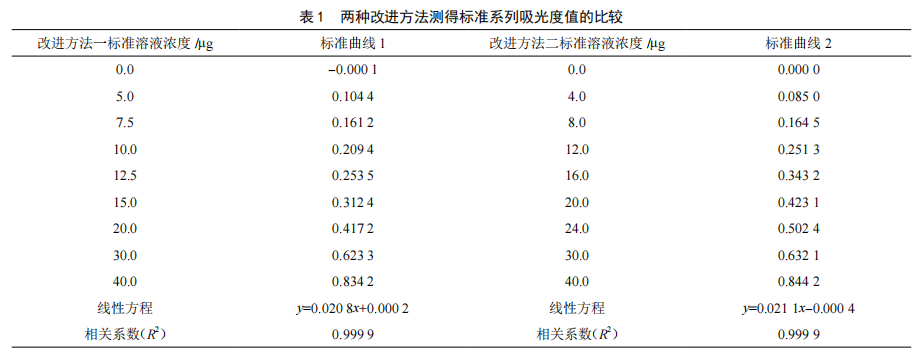
分光光度法测定食品中亚硝酸盐含量标准曲线线性范围的研究
-
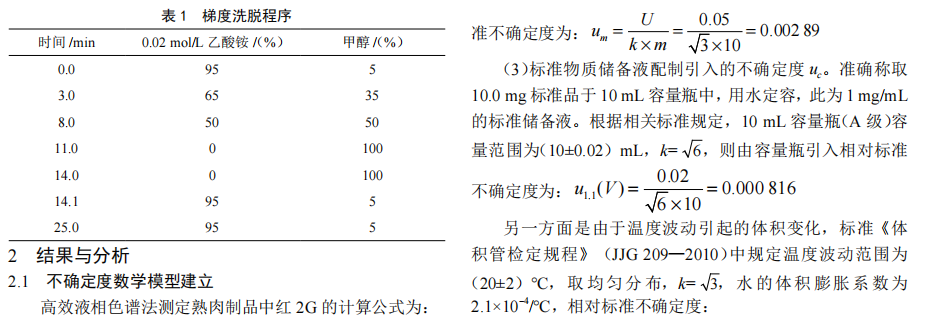
高效液相色谱法测定熟肉制品中非法添加物红2G的不确定度评定
-

离子色谱法测定天然矿泉水中溴酸盐的不确定度评定
-
基于多光谱图像技术的食品质量检测方法
-
应用拉曼光谱技术开展乳制品安全快检的探讨
-

运用质控数据评定农产品检测中的测量不确定度
-
2,6-二氯酚靛酚滴定法与碘量法测定蔬菜水果中维生素C
-

ICP-MS法测定药食同源性食物中的重金属及有害元素
-
ICP-MS法同时测定矿泉水界限指标中5种元素
-
芹菜农药残留检测及膳食摄入风险评估
-
QuEChERS/GC-MS/MS测定蔬菜中43种农药残留





