利用HPLC内标法测定益生菌类保健食品中低聚木糖的含量
2021-11-12 16:41:19 来源: 食品安全导刊
张超然1,王墨阳2,林 林1
(1.哈尔滨美华生物技术股份有限公司,黑龙江哈尔滨 150010;
2.哈尔滨市疾病预防控制中心,黑龙江哈尔滨 150001)
摘 要:低聚木糖作为益生元,常应用于益生菌类保健食品中。本文利用高效液相色谱-紫外检测器,以盐酸氨基葡萄糖作为内标物,进行柱前衍生化后测定低聚木糖在益生菌保健食品中的含量。将样品溶解后,经硫酸水解,以苯基甲基吡唑啉酮()作为衍生化试剂,选择流动相为乙腈-0.05 mol/L的乙酸铵溶液,进行梯度洗脱,水解前后的木糖含量差值,即为低聚木糖的含量。该测定方法在质量浓度20~1 000 μg/mL的范围内呈现良好的线性关系,其相关系数(2)为0.999 6,检出限和定量限分别是1.9 mg/100 g和6.8 mg/100 g。加标回收率在88.7%~98.5%,相对标准偏差在1.1%~4.0%;在重复性试验中,相对标准偏差为1.03%。结果表明该方法在测定益生菌类保健食品中低聚木糖含量具有良好的准确性和灵敏度。
关键词:低聚木糖;PMP柱前衍生;益生菌类保健食品
低聚木糖来源广泛,可从甘蔗渣、玉米棒、麦麸、稻壳和棉秆等植物中提取获得[1],含有2~10个木糖分子由β-1,4-糖苷键连接的低聚物[2]。低聚木糖具有多种生物活性,尤其是在益生菌保健食品中,作为益生元,为益生菌供能,具有促进肠道益生菌的生长的作用[3-4],同时还可以加速脂肪代谢,改善钙的吸收[5],预防龋齿[6],作为抗氧化剂[2]。因其具有较好的稳定性[1],已被广泛应用于食品、保健食品中。
现有的对低聚木糖测定的标准GB/T 35545—2017和QB/T 2984—2008,主要适用于以玉米芯为原料,经酶解精制而成的低聚木糖,两个标准为低聚木糖原料的测定标准,其检测设备为高效液相色谱-示差检测器,需要的标准品为木糖,木二糖至木六糖,葡萄糖及-阿拉伯糖。该方法作为食品中添加的低聚木糖的检测手段,检测成本高,同时益生菌类保健食品中常含有大量的蛋白质,大量蛋白质在醇沉过程中包裹低聚木糖,使测量数据偏低,需要针对其测定方法进行进一步探究,可应用高效液相色谱-蒸发光散射检测器进行食品中低聚木糖的测定[7-8]。有研究表明衍生化技术作为糖类物质分析的新技术,通过离子化效率,从而提高检测的灵敏度。其中,以苯基甲基吡唑啉酮()为代表的,取代的吡唑啉酮类衍生试剂和糖链还原性末端的反应在弱碱性介质中进行,具有条件温和、衍生产物稳定无立体异构体紫外吸收强和适于多种类型糖链分析等优点,被广泛应用于糖类检测[9]。林钦恒等[10]利用柱前衍生的方法测定了润肠通便类保健食品中低聚木糖的含量,钱韵旭等[11]对白花蛇舌草多糖成分分析中,利用柱前衍生-高效液相的方法确定其由鼠李糖、葡萄糖、半乳糖、木糖和阿拉伯糖组成。本文利用PMP柱前衍生-高效液相色谱法对于益生菌类保健食品中低聚木糖含量的测定进行系统地分析,并以盐酸氨基葡萄糖作为内标物质,对于本类产品中低聚木糖的检测具有重要的意义。
1 材料与方法
1.1 材料与试剂
益生菌类保健食品产品,来自于哈尔滨美华生物技术股份有限公司。
木糖标准品(纯度为99.5%),中国药品生物制品检定所;D-氨基葡萄糖标准品(纯度为99%),中国药品生物制品检定所;1-苯基-3-甲基-5-吡唑啉酮(PMP,分析纯),天津市大茂化工有限公司;乙腈(色谱纯),美国FISHER公司;乙酸铵(优级纯),福晨(天津)化学试剂有限公司;甲醇(色谱纯),美国FISHER公司;试验用水为去离子水;氢氧化钠、盐酸、硫酸、三氯甲烷均为分析纯,购自天津化学试剂公司。
1.2 仪器与设备
Ultimate 3000高效液相色谱仪(配有紫外检测器),赛默飞世尔科技;HH4恒温水浴锅,无锡沃信仪器制造有限公司;KQ-50B型超声波清洗机,昆山市超声仪器有限公司;FA2104电子分析天平(精度:0.000 1 g),上海良平仪器仪表有限公司;VORTEX-KB3旋涡混合器,海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 色谱条件
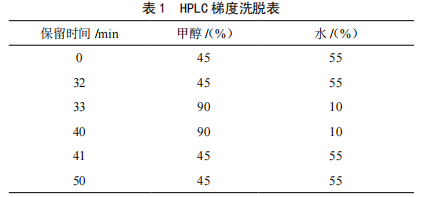
色谱柱:Hypersil GOLD C18分析柱(250 mm×4.6 mm,5 μm),美国FISHER公司;流动相:乙腈-0.05 mol/L的乙酸铵溶液,梯度洗脱;柱温:30 ℃;波长:250 nm;流速:1.0 mL/min;进样量:10 μL。
1.3.2 标准溶液系列的配制
(1)内标溶液制备。配制适量10 mg/mL的D-盐酸氨基葡萄糖溶液,作为内标溶液。
(2)标准溶液配制。准确称取适量木糖标准品于100 mL容量瓶中,用去离子水溶解配制成10 mg/mL的标准储备溶液,再将储备溶液稀释成20.0 μg/mL、50.0 μg/mL、100.0 μg/mL、200.0 μg/mL、400.0 μg/mL和800.0 μg/mL的系列工作溶液,并分别按比例加入内标溶液。
1.3.3 样品前处理
(1)样品水解前溶液制备。准确称取样品1.5 g(精确度为0.000 1 g),用0.005 mol/L硫酸溶液溶解并超声溶解,定容至10 mL,取0.5 mL样品溶液,加入0.5 mL D-盐酸氨基葡萄糖溶液,定容至50 mL。
(2)样品水解后溶液制备。准确称取样品1.5 g(精确度为0.000 1g),用0.005 mol/L硫酸溶液溶解并超声溶解,定容至10 mL,取0.5 mL样品溶液,添加0.5 mL D-盐酸氨基葡萄糖溶液,添加120 μL的4.0 mol/L硫酸溶液于沸水浴水解100 min,取出,冷却,添加240 μL的4.0 mol/L NaOH溶液,用水定容至50 mL,备用。
1.3.4 衍生化反应
标准溶液与样品水解前后溶液各吸取400 μL,加0.5 mol/L的PMP(1-苯基-3-甲基-5-吡唑啉酮)甲醇溶液与0.3 mol/L的氢氧化钠溶液各400 μL,混匀,70 ℃水浴反应120 min。再加0.3 mol/L的盐酸溶液调节至中性,混匀,冷却后用三氯甲烷洗涤3次,弃去三氯甲烷液,水层过0.45 μm滤膜,待上机测定[10]。
1.4 低聚木糖的计算
计算水解前后木糖含量的差值即为低聚木糖(以木糖计)的含量。
2 结果与分析
2.1 流动相的选择
根据相关文献,对常用于该试验的流动相进行了总结,发现乙酸铵[2,8,11]和磷酸钠[12]都可作为流动相,不同的pH,对各糖类物质出峰时间及分离程度有影响,所以本试验选取0.05 mol/L乙酸铵溶液,pH为5.0,7.0,8.0,分别用乙酸和三乙胺进行pH调节;0.05 mol/L磷酸钠,pH为8.0,用磷酸进行调节,以上作为A相。B相为乙腈,进行梯度洗脱。根据内标和外标物及产品的峰分离程度及出峰时间,选择0.05 mol/L乙酸铵溶液(pH=5.0)-乙腈作为流动相进行梯度洗脱,分离效果最好。
2.2 内标物的选择
由于前处理衍生化试验中,需对溶液进行pH调节,且前处理相对复杂,从而试验操作误差影响其溶液中木糖的含量,所以根据糖类极性上的差异,选取盐酸氨基葡萄糖作为内标物质,对其测定值进行校正。同时,盐酸氨基葡萄糖在波长250 nm下具有较大的吸收,且不会干扰产品中其他成分,所以盐酸氨基葡萄糖对于该方法是比较好的内标物质。
2.3 标准曲线、检出限和定量限
本试验配制的标准溶液浓度为20.0 μg/mL,50.0 μg/mL,100.0 μg/mL,200.0 μg/mL,400.0 μg/mL和800.0μg/mL,以木糖标准品的质量浓度(X)为横坐标,衍生产物的响应值(Y)为纵坐标,低聚木糖质量浓度在20~1 000 μg/mL的范围内呈现良好的线性关系,得到的线性方程y=1.384 4x-1.098 6,相对系数(2)为0.999 6。按3倍信噪比计算检出限为1.9 mg/100 g;以10倍信噪比计算定量限,定量限为6.8 mg/100 g。
2.4 准确度试验
试验选取了两款低聚木糖含量不同的益生菌类保健食品样品,分别测出本底值,在根据不同样品的低聚木糖含量,添加标准品(按样品含量的80%、100%和120%),每个水平制备5份样品进行测定。按照“1.2.4衍生化反应”试验步骤进行测定,计算回收率以及相对标准偏差(值)。结果表明,平均回收率为88.7%~98.5%,相对标准偏差为1.1%~4.0%。

2.5 重复性试验
精密吸取样品制备液10 μL,连续6次进样,测得的相对标准偏差为1.03%,证明该方法的精密度较高。

2.6 产品测定
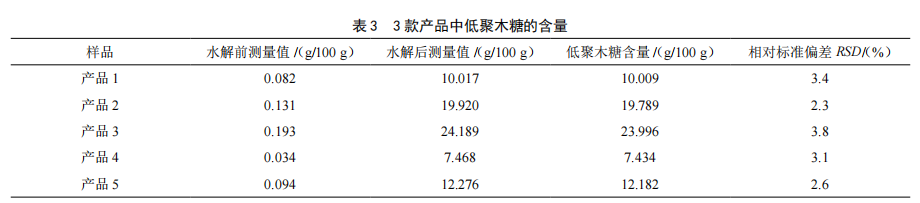
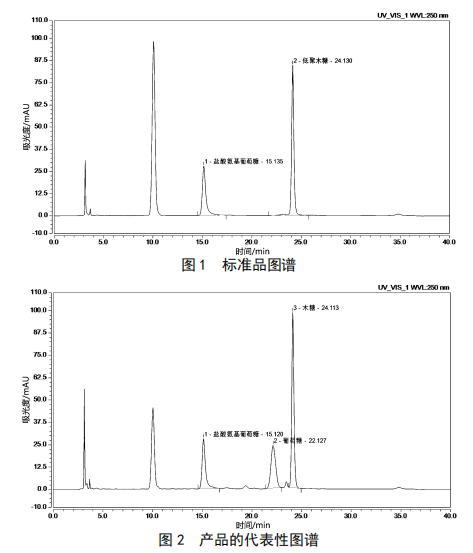
选取本公司5款益生菌类保健食品(n=3)进行检验测定低聚木糖含量,检测结果见表3,色谱图见图1和图2。产品中含少量木糖成分,所以水解前测量值不为零,在计算时应减去。
3 结论
本文建立了测定益生菌类保健食品中低聚木糖的测定方法,采用高效液相色谱-紫外检测器并结合PMP柱前衍生化进行测定。结果表明,由于样品需经过水解及柱前衍生化,前处理较为复杂,选择以盐酸氨基葡萄糖作为内标物质,对实验中产生的误差进行了校正,从而提高了检测准确性。同时对方法的线性、灵敏度、回收率、重复性及实际产品测定等多个方面进行了考察。结果表明,该方法具有较高的灵敏性及准确性,可应用于相关益生菌类保健食品的低聚木糖含量的测定。
参考文献
[1]ANA F A C,PEDRO O N, DOUGLAS S D,et al.Xylo-oligosaccharides from lignocellulosic materials: chemical structure,health benefits and production by chemical and enzymatic hydrolysis[J].Food Research International,2013,51(1):75-85.
[2]PU J H,ZHAO X,WANG Q C,et al.Development and validation of a HPLC method for determination of degree of polymerization of xylo-oligosaccharides[J]. Food chemistry,2016,213:654-659.
[3]CHUAN Y C,HSU C K,KO C Y,et al.Dietary intake of xylooligosaccharides improves the intestinal microbiota, fecal moisture,and pH value in the elderly[J].Nutrition Research,2007,27(12):756-761.
[4]IRA J,VIKASHA K,SATYANARAYANA T.Xylooligosaccharides:an economical prebiotic from agroresidues and their health benefits [J].Indian Journal of Experimental Biology,2015,53(3):131-142.
[5]
KATRIEN S,CHRISTOPHE M,JAN D.Non-digestible oligosaccharides with prebiotic properties[J].Critical Reviews in Food Science Nutrition,2006,46(6):459-471.
[6]SAMANTA A K,JAYAPAL N,JAYARAM C,et al.
Xylooligosaccharides as prebiotics from agricultural by-products:Production and applications [J].Bioactive Carbohydrates and Dietary Fibre,2015,5(1):62-71.
[7]王辰,李建平,张明月.高效液相色谱仪-蒸发光散射检测器测定保健食品中低聚木糖的含量[J].中国卫生检验杂志,2015,25(21):3631-3632.
[8]WANG W Z,WANG Y Q,CHEN F,et al.Comparison of determination of sugar-PMP derivatives by two different stationary phases and two HPLC detectors:C18 vs. amide columns and DAD vs.ELSD-ScienceDirect[J].Journal of Food Composition and Analysis,2020,96(26):1037.
[9]SUSUMU H,EIKO A,SHEIGEO S,et al.High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl5-pyrazolone derivatives[J].Academic Press,1989,180(2):351-357.
[10]林钦恒,郑家概,张飞,等.柱前衍生化HPLC法测定润肠通便类保健食品中低聚木糖[J].食品工业,2018,39(12):269-272.
[11]钱韵旭,刘裴,李莉,等.白花蛇舌草多糖的分离纯化及PMP柱前衍生高效液相分析[J].云南中医学院学报,2010,33(3):43-46.
[12]LI H L,Long C,Zhou J,et al.Rapid analysis of mono-saccharides and oligo-saccharides in hydrolysates of lignocellulosic biomass by HPLC [J].Biotechnology Letters,2013,35(9):1405-1409.
作者简介:张超然(1989—),女,辽宁黑山人,硕士,工程师。研究方向:食品质量与安全。
热点推荐
-

使用梅特勒-托利多X光机的五大理由
-

小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金秋喜迎初丰收
-

全球食品创新平台第五期已启动,携手共创安全、健康、绿色的未来
-
特医食品不是药,却是临床治疗的关键支撑
-

“喂饱”体内的益生菌,肠道更健康
-

利用HPLC内标法测定益生菌类保健食品中低聚木糖的含量
-
ATP生物荧光增幅法在食品微生物污染检测中的应用
-

高效液相色谱仪、酶标仪和快检仪检测小麦中呕吐毒素的对比分析
-
高效液相色谱法测定烤鱼中的苯并[α]芘
-
食品中霉菌检测方法的改进研究
-
超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量
-
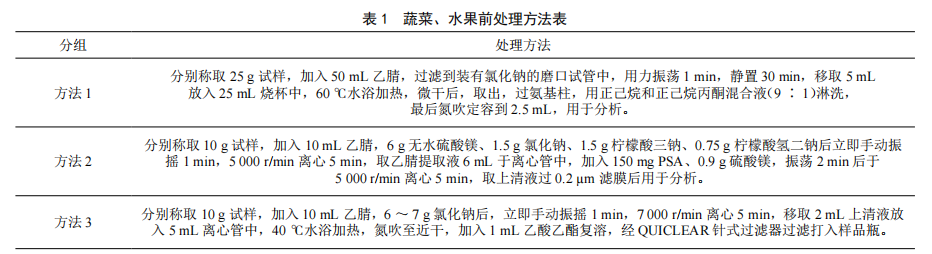
不同前处理方法对蔬菜、水果农药残留GC-MS/MS检测结果的影响分析
-
气相色谱-质谱联用法测定白花蛇舌草中10种有机磷农药残留量
-
基于GC和GC-MS技术检测山茶油掺伪
-
分光光度法测定食品中亚硝酸盐含量标准曲线线性范围的研究
-
高效液相色谱法测定熟肉制品中非法添加物红2G的不确定度评定
-

离子色谱法测定天然矿泉水中溴酸盐的不确定度评定
-
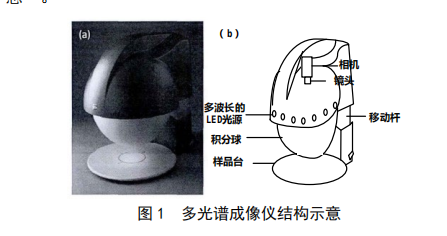
基于多光谱图像技术的食品质量检测方法
-
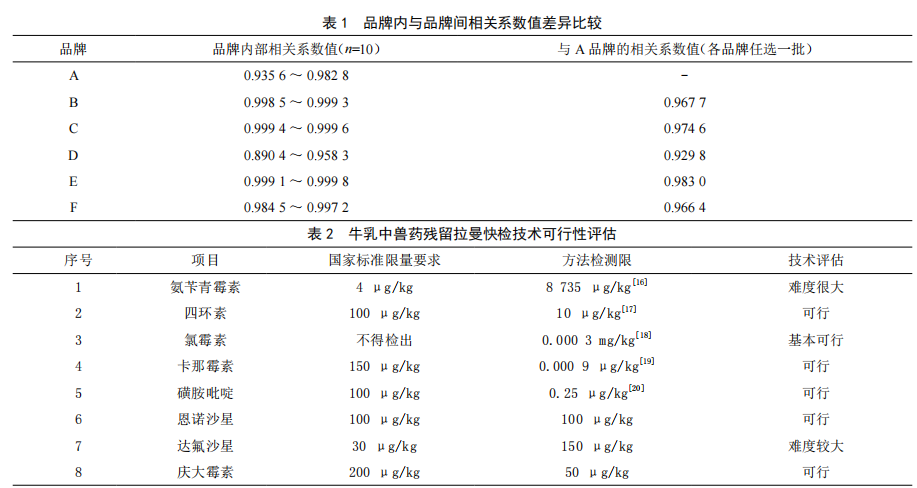
应用拉曼光谱技术开展乳制品安全快检的探讨
-

运用质控数据评定农产品检测中的测量不确定度
-
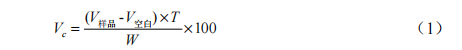
2,6-二氯酚靛酚滴定法与碘量法测定蔬菜水果中维生素C
-

ICP-MS法测定药食同源性食物中的重金属及有害元素
-
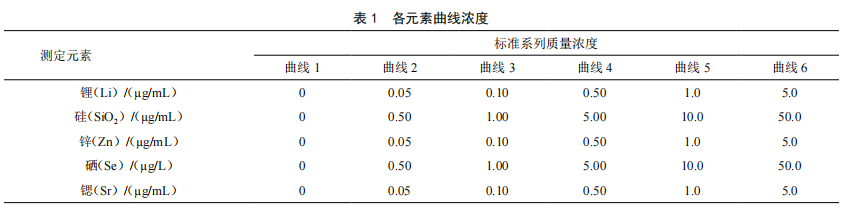
ICP-MS法同时测定矿泉水界限指标中5种元素
-
芹菜农药残留检测及膳食摄入风险评估
-
QuEChERS/GC-MS/MS测定蔬菜中43种农药残留
-
不同种类茶叶中茶多酚含量的测定和分析
-
市售大米重金属As、Hg、Pb、Cd污染情况调查
-

酶法在南瓜枸杞保健酒中的应用
-
高效液相色谱柱后衍生法测定大黄䗪虫丸中的黄曲霉毒素
-

索氏抽提法与滤袋法测定坚果与籽类食品中脂肪含量的比较





