食品中霉菌检测方法的改进研究
2021-11-11 15:29:31 来源: 食品安全导刊
刘胜桃,宋 鸽,王秀艳,李慧娟,常建军,王 宏
(蒙牛乳业(沈阳)有限责任公司,辽宁沈阳 110122)
摘 要:目的:研究一种可行、适用、准确的霉菌检测培养方法,来解决培养过程中培养基干裂、环境污染、菌落计数不准确的问题。方法:对膜包裹法、培养盒法、直接培养法3种方法进行比较,来评价3种方法的可行性、适用性和准确性。结果:采用直接培养法培养的空白和样品出现较大程度的污染及干裂现象,膜包裹法、培养盒法培养的样品未造成污染,培养基未干裂不影响菌落计数。结论:采用隔离的方法能够有效控制培养基干裂和污染的问题,提高菌落计数的准确性,同时可避免霉菌孢子在培养、观察过程中扩散到环境中,造成污染,培养盒法较膜包裹法更方便、快捷、易观察,是实验室值得推广的培养方法。
关键词:霉菌;污染;干裂;隔离;培养
霉菌是丝状真菌的统称,广泛分布于土壤、水、空气等自然环境中[1-3],因此食品极易被霉菌污染[4]。霉菌可引起食品、农产品的发霉变质,霉菌毒素可导致慢性中毒具有致癌、致畸、致突变作用[5],可对人体健康造成危害[6-12]。霉菌的监测也成为食品检验技术与食品卫生质量评价中的重要组成部分[13-16],我国先后5次修订了食品中霉菌计数的方法标准[17-21],据此我国各级监督检测机构全面开展食品中霉菌的检测工作,自《食品安全国家标准 食品微生物学检验 霉菌和酵母菌计数》(GB 4789.15—2016)实施以来将原标准中倒置平板培养改成正置平板培养,霉菌培养中的污染和培养基干裂现象频发,这主要是因为霉菌菌落可产生数量巨大的孢子,同时霉菌的孢子具有小、轻、干、多、休眠期长和抗逆性强等特点,任何一个孢子在适宜条件下都能发展成新的个体。常规霉菌检测的培养过程中,以及观察移动过程中,不可避免地造成空气流动,霉菌孢子可趁机飘散进入空气中并随处散播、繁殖,引起严重的交叉污染和外部侵染[22]。又因霉菌的培养时间较长,培养基在培养过程中水分损失较大,即使加大了培养基的倾注量,也无法避免培养基干裂,从而导致影响菌落计数的问题,而目前这两项常见且棘手的问题始终困扰着相关人员,且无有效的控制
措施。
本实验室在日常霉菌检测中采取两种隔离培养方法,即膜包裹法、培养盒法,对霉菌孢子扩散、污染及培养基干裂的控制效果显著,且成本低廉,操作简便,对比《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)(以下简称国标法)的计数结果,探讨霉菌检测过程中隔离式培养方法的可行性、实用性和准确性[23-27]。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
霉菌和酵母质控样(QC-FD-020),来自中国检验检疫科学研究院测试评价中心;霉菌和酵母质控样(A062018M),来自北京美正检测技术有限公司。
1.1.2 试剂
孟加拉红琼脂,CM164,北京陆桥技术服务有限公司。
1.1.3 耗材
霉菌培养盒,食品级PVC材质,分为4个凹槽,凹槽与培养皿直径及高度相匹配,每个凹槽有3个透气孔,培养过程中形成有氧培养环境,此装置为一次性使用,计数后的培养皿连同装置一同高压灭菌处理即可;保鲜膜或封口膜。
1.2 仪器与设备
BSC-1300IIB2生物安全柜(上海博迅实业有限公司医疗设备厂);SSW-600-2S恒温水箱(上海博讯实业有限公司医疗设备厂);MJX-250BⅢ霉菌培养箱(天津市泰斯特仪器有限公司);MSⅢ basic漩涡混合器(德国IKA)。
1.3 实验方法
1.3.1 膜包裹培养法
称取25 g样品加入225 mL无菌生理盐水中,充分振摇,制成1∶10样品匀液,取1∶10样品匀液1 mL,加入含有9 mL无菌生理盐水的试管中,旋涡混匀,制成1∶100的样品匀液,同时做空白对照,及时倾注冷却至46 ℃的孟加拉红培养基,待琼脂凝固后,在洁净室中将平皿4~6个叠放,外层包裹保鲜膜或封口膜,在叠放的皿与皿之间用刀划上长约2 cm的透气孔,每层划2~3个透气孔,正置平板,置(28±1)℃培养箱中培养,同时以直接培养法的样品作为对照,观察并记录培养至第5 d的结果。
1.3.2 霉菌盒培养法
称取25 g样品加入225 mL无菌生理盐水中,充分振摇,制成1∶10样品匀液,取1∶10样品匀液1 mL,加入含有9 mL无菌生理盐水的试管中,旋涡混匀,制成1∶100的样品匀液,同时做空白对照,及时倾注冷却至46 ℃的孟加拉红培养基,待琼脂凝固后将平皿正置于霉菌盒中,每个槽可放置一个培养皿,将上盖盖严即可放入(28±1)℃培养箱培养,同时以直接培养法的样品做对照,观察并记录培养至第5 d的结果。
1.3.3 直接培养法
称取25 g样品加入225 mL无菌生理盐水中,充分振摇,制成1∶10样品匀液,取1∶10样品匀液1 mL,加入含有9 mL无菌生理盐水的试管中,旋涡混匀,制成1∶100的样品匀液,同时做空白对照,及时倾注冷却至46 ℃的孟加拉红培养基,待琼脂凝固后,正置平板,置(28±1)℃培养箱中培养,同时以直接培养法的样品作对照,观察并记录培养至第5 d的结果。
2 结果与分析
2.1 膜包裹培养法、霉菌盒培养法与直接培养法结果比较
对8组不同类型的样品(已知不含菌样品)进行霉菌检测,同时监控5组空白实验,每组样品每个稀释度均进行两组平行检测,用膜包裹培养法和霉菌盒装置培养的8组实验样品及5组空白对照,均未出现污染、培养基干裂的情况,同时使用菌片法进行检验验证结果一致。而采用直接法培养的13组样品,10组样品出现不同程度的污染,部分培养基干裂,样品污染情况占比69%,培养基干裂数量占比77%。
实验结果表明,膜包裹培养法和霉菌盒装置培养法均可将环境中的污染来源完全隔离,且可以保证在较长的培养时间内降低培养基水分的损失。但霉菌盒装置在结果观察过程无需打开培养盒,可直接透过培养盒清晰地对菌落进行观察计数,达到从样品培养到出具结果,最终到废弃物处理环节,培养物与外界环境始终保证有效的隔离,避免了环境、样品、人员相互污染的风险。膜包裹培养法、霉菌盒正置培养法与直接法培养结果如表1所示。
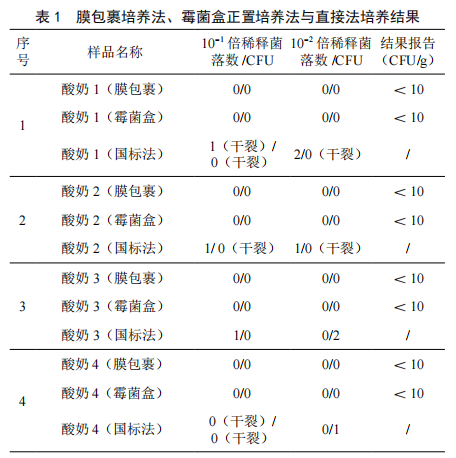
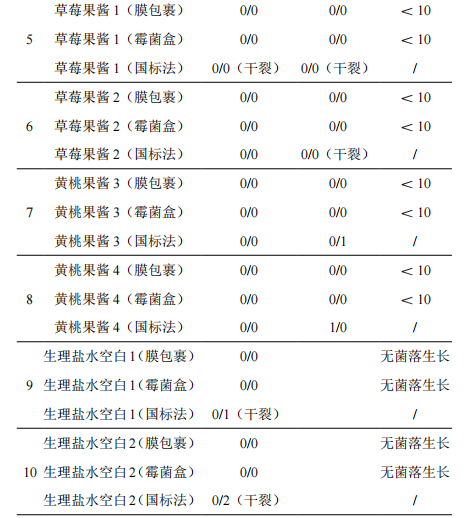

2.2 膜包裹培养法、霉菌盒培养法准确性测试
使用膜包裹培养法及霉菌盒培养法对6组不同特性区间及不同厂家的霉菌质控样品进行检测,每组样品、每个稀释度均进行两组平行检测,检测结果均在质控样品特性区间,将膜包裹培养法得到的结果与霉菌盒培养法得到的结果配对检验,p=0.18>0.05,表明无显著性差异;培养过程中未出现培养基干裂及污染的现象,空白对照均无菌落生长,证明了两种隔离培养方式不会对霉菌的生长产生影响,如表2所示。
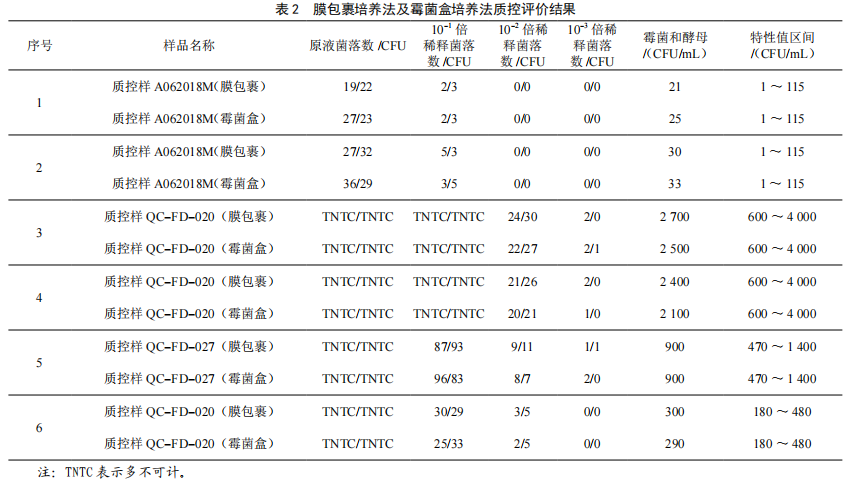
3 结论与讨论
本研究通过对膜包裹法、霉菌盒培养法、直接培养法培养过程进行比较,发现膜包裹法、霉菌盒培养法可有效解决在培养过程中水分流失造成的培养基干裂问题,且无污染,同时对质控样品检测发现上述两种隔离培养方式不影响菌落计数,不影响霉菌的生长。因膜包裹法观察过程中需要将膜拆开,而霉菌盒培养法较膜包裹法的优势在于在观察和计数过程中不需要打开霉菌盒装置,透过装置可清晰对菌落进行观察计数,从平板培养到最终废弃物处置,培养物与外界环境始终保证有效的隔离措施,避免了环境、样品、人员相互污染的风险。操作方便、成本低廉,霉菌培养盒也可应用于培养时间较长和(或)温度较高的微生物检测项目,例如嗜热需氧芽孢检测等,是实验室值得推广的培养方法。
参考文献
[1]WANG X,WU Q H,WAN D,et al.Fumonisins: oxidative stress-mediated toxicity and metabolism in vivo and in vitro[J].Archives of Toxicology,2016,90(1):81-101.
[2]BHAT R,REDDY K R N.Challenges and issues concerning mycotoxins contamination in oil seeds and their edible oils: Updates from last decade[J].Food Chemistry,2017,215:425-437.
[3]侯佳琪,王璐,何苗,等.糕点中霉菌的检验和控制[J].食品安全导刊,2017(24):93.
[4]韩涛,杨雪妮,张芳.霉菌检测中封闭式培养方法的建立和应用[J].食品科学,2019,40(16):308-313.
[5]张晨夕,韩阳,陈丹丹.纸张中霉菌检测方法研究[J].黑龙江造纸,2019(2):18-24.
[6]董曼佳,杨其亚,孙伟,等.拮抗酵母菌控制玉米赤霉烯酮的研究进展[J].食品科学,2016,37(1):230-234.
[7]LIN P F,CHEN F L,SUN J,et al.Mycotoxin zearalenone induces apoptosis in mouse Leydig cells via an endoplasmic reticulum stress-dependent signalling pathway[J].Reproductive toxicology,2015,52:71-77.
[8]GAO W,JIANG L P,GE L,et al.Sterigmatocystin-induced oxidative DNA damage in human liver-derived cell line through lysosomal damage[J].Toxicology in vitro,2015,29(1):1-7.
[9]MCKEAGUE M,BRADLEY C R,DE GIROLAMO A,et al.Screening and initial binding assessment of fumonisin B1 aptamers[J].International Journal of Molecular Sciences,2010,11(12):4864-4881.
[10]IQBAL S Z,JINAP S,PIROUZ A A,et al.Aflatoxin M1 in milk and dairy products, occurrence and recent challenges: a review[J].Trends in Food Science & Technology,2015,29(1):1-7.
[11]CARVAJAL-MORENO M.Metabolic changes of aflatoxin B1 to become an active carcinogen and the control of this toxin[J].Immunome Research,2015,11(3):2-14.
[12]SELVARAJ J N,WANG Y,ZHOU L,et al.Recent mycotoxin survey data and advanced mycotoxin detection techniques reported from China: a review.[J].Food Additives and Contaminants-Part A Chemistry,Analysis,Control,Exposure and Risk Assessment,2015,32(4):440-452.
[13]韦尚伟.食品检验技术中存在的问题[J].现代食品,2017(5):61-63.
[14]邹军.我国食品检验技术中存在问题及解决方法探析[J].科技创新与应用,2016(8):297.
[15]陈平燕.我国食品检验技术中存在的问题探析[J].广东蚕业,2017,51(10):94-95.
[16]高景会.食品安全检测中存在的问题及解决对策[J].现代食品,2017(8):12-13.
[17]中华人民共和国卫生部.食品卫生微生物学检验 霉菌和酵母数测定:GB/T 4789.15—1984[S].北京:中国标准出版社,1984.
[18]中华人民共和国卫生部.食品卫生微生物学检验 霉菌和酵母数计数:GB/T 4789.15—1994[S].北京:中国标准出版社,1994.
[19]中华人民共和国卫生部.食品卫生微生物学检验 霉菌和酵母数计数:GB/T 4789.15—2003[S].北京:中国标准出版社,2003.
[20]中华人民共和国卫生部.食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2010[S].北京:中国标准出版社,2010.
[21]国家卫生和计划生育委员会.食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2016[S].北京:中国标准出版社,2016.
[22]刘永永,纪丹,刘晓海,等.生化培养箱内部的循环风向对霉菌检测结果的影响[J].食品安全质量检测学报,2020,11(1):262-268.
[23]李若旦才让.提高食品检验准确性的措施[J].食品安全导刊,2016(18):33.
[24]陈创辉.食品检验结果的影响因素及提高检验结果准确性的措施[J].食品安全导刊,2018(18):57.
[25]陈杰.科学做好食品安全检验检测工作[J].中国食品,2018(6):68-70.
[26]徐慧萍,李翠霞.我国乳品质量安全的影响因素分析[J].中国食物与营养,2012,18(8):5-8.
[27]郭利亚,王加启,李发弟.浅析我国生鲜乳质量安全监管及对策[J].中国畜牧杂志,2012,48(12):42-45.
热点推荐
-

使用梅特勒-托利多X光机的五大理由
-

小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金秋喜迎初丰收
-

全球食品创新平台第五期已启动,携手共创安全、健康、绿色的未来
-
特医食品不是药,却是临床治疗的关键支撑
-

“喂饱”体内的益生菌,肠道更健康
-

食品中霉菌检测方法的改进研究
-
超高效液相色谱法测定不同香型白酒中乳酸和乙酸的含量
-
不同前处理方法对蔬菜、水果农药残留GC-MS/MS检测结果的影响分析
-
气相色谱-质谱联用法测定白花蛇舌草中10种有机磷农药残留量
-
基于GC和GC-MS技术检测山茶油掺伪
-
分光光度法测定食品中亚硝酸盐含量标准曲线线性范围的研究
-
高效液相色谱法测定熟肉制品中非法添加物红2G的不确定度评定
-

离子色谱法测定天然矿泉水中溴酸盐的不确定度评定
-
基于多光谱图像技术的食品质量检测方法
-
应用拉曼光谱技术开展乳制品安全快检的探讨
-

运用质控数据评定农产品检测中的测量不确定度
-
2,6-二氯酚靛酚滴定法与碘量法测定蔬菜水果中维生素C
-

ICP-MS法测定药食同源性食物中的重金属及有害元素
-
ICP-MS法同时测定矿泉水界限指标中5种元素
-
芹菜农药残留检测及膳食摄入风险评估
-
QuEChERS/GC-MS/MS测定蔬菜中43种农药残留
-
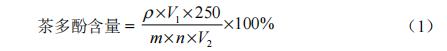
不同种类茶叶中茶多酚含量的测定和分析
-
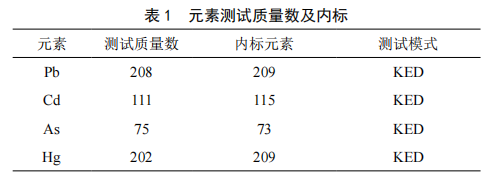
市售大米重金属As、Hg、Pb、Cd污染情况调查
-

酶法在南瓜枸杞保健酒中的应用
-
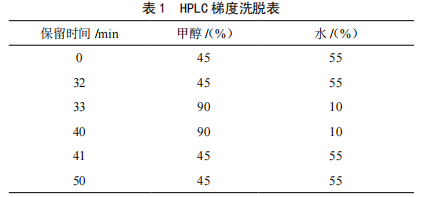
高效液相色谱柱后衍生法测定大黄䗪虫丸中的黄曲霉毒素
-

索氏抽提法与滤袋法测定坚果与籽类食品中脂肪含量的比较
-
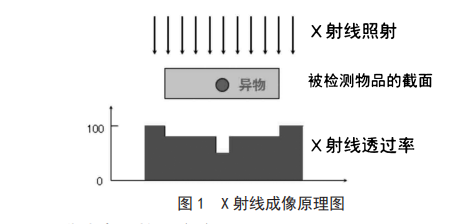
应用于罐头产品的X射线异物检测系统
-

2021年春季洞庭湖区章姬草莓农药残留检测分析
-
HPLC法同时测定茶叶中咖啡因和儿茶素
-

分光光度法测定发酵型枸杞酒中的枸杞多糖含量





