分散液液微萃取-超高效液相色谱-串联质谱法测定茶饮料中黄曲霉毒
2021-08-04 15:42:51 来源: 食品安全导刊
分散液液微萃取-超高效液相色谱-串联质谱法测定茶饮料中黄曲霉毒素B1和B2
陈佩佩1,2,陈琳珊1,2,陈 茹1,3
(1.广东省食品工业公共实验室,广东广州 511442;2.广东省食品工业研究所有限公司,广东广州 511442;
3.广东省质量监督食品检验站,广东广州 511442)
摘 要:建立了分散液液微萃取(DLLME)-超高效液相色谱-串联质谱法(UPLC-MS/MS)对茶饮料中的黄曲霉毒素B1和黄曲霉毒素B2进行同时测定的方法。样品以盐酸为分散剂,3-氯苯胺为萃取剂进行萃取,调节pH至6后,离心分层,弃去上层水相,下层乙腈定容,使用电喷雾电离源正离子模式进行测定。结果表明,两种黄曲霉毒素在1.0~100 μg/L范围内呈良好线性关系,相关系数大于0.999 3,平均回收率为71.2%~91.0%,检出限均为20.0 ng/kg,定量限均为50.0 ng/kg,相对标准偏差为2.23%~6.43%。该方法操作快速简便、回收率好、灵敏度高、重现性好,适用于日常测定茶饮料中的黄曲霉毒素。
关键词:分散液液微萃取;超高效液相色谱-串联质谱;茶饮料;黄曲霉毒素
黄曲霉毒素(Aflatoxin,AFT)是由黄曲霉和寄生曲霉等某些菌株产生的一类次生代谢物[1],从化学结构上,均属于双呋喃香豆素衍生物,是一类毒性极强的双呋喃环类毒素。由于AFT产生菌在自然界中广泛存在,很多的动植物源性食品都有可能存在污染[2],尤其在植物的种植、加工、运输、储存等过程都有可能被产生菌污染,从而产生毒素[3]。同时,黄曲霉毒素在自然条件下稳定性较强,极性较低,难以用水或紫外线完全除去,只有在强碱性条件下容易分解[4],过多的摄入引起致癌、致畸和致突变等毒性效应[5],其中以黄曲霉毒素B1的毒性致癌性最强。近年来,我国黄曲霉毒素污染事件频繁发生,因此,建立高效、通用、灵敏的相关检测方法,对企业生产,消费者安全都有十分重要的意义。
目前,国内外对黄曲霉毒素的检测方法主要有高效液相色谱法[6-7]、液相色谱-串联质谱法[8-9]或液相色谱-高分辨质谱法[10]、免疫学检测法[11-12]。高效液相色谱法操作烦琐,尽管检测器灵敏度高,但杂质多,分析时间较长,免疫学检测法虽然能大批量检测,但易与类似结构的化合物发生反应,出现假阳性,结果偏差较大。质谱法应用较广,前处理简单,定性定量能力好,但高分辨质谱价格昂贵,难以广泛应用。本文以分散液液微萃取为前处理手段,建立了液相色谱-串联质谱法对茶饮料中的黄曲霉毒素B1和B2进行测定。方法学验证结果表明,方法整体方便快捷,灵敏度高,回收率好,可日常大批量检测。
1 材料与方法
1.1 仪器与设备
API4000Q质谱仪、岛津LC-20AD液相色谱系统、4k-15离心机、IKA Vortex4涡旋混匀器、Milli-Q Advantage A10 超纯水系统。
1.2 材料与试剂
茶饮料,广州市售;黄曲霉毒素B1、黄曲霉毒素B2,纯度大于98%,德国Dr.Ehrenstorfer公司;甲酸、乙腈、3-氯苯胺、三氯甲烷,均为HPLC级,美国Thermo Fisher公司;盐酸、磷酸钠,均为分析纯,广州试剂厂;实验用水为Milli-Q超纯水。
1.3 样品前处理
于15 mL尖底离心管中加入1 mL 2 mol/L的盐酸溶液和50 μL 3-氯苯胺充分混匀,然后加入5 mL样品,涡旋提取10 min,使用1 mol/L的磷酸钠溶液调节pH至6,涡旋混匀后置于离心机中以4 500 r/min离心5 min,使3-氯苯胺沉淀。除去上层水相,下层3-氯苯胺用乙腈定容至
200 μL,待测定。
1.4 标准曲线的绘制
标准储备溶液:分别准确称取黄曲霉毒素B1和黄曲霉毒素B2标准品各0.050 0 g于100 mL棕色具塞容量瓶中,用乙腈稀释成500 mg/L的储备液。
标准中间溶液:用乙腈将上述储备液稀释成浓度为
10 mg/L的标准中间液。
溶剂曲线:使用乙腈配制成1.0 µg/L、2.0 µg/L、5.0 µg/L、10 µg/L、20 µg/L、50 µg/L和100 µg/L的标准使用液,绘制校准曲线。
基质曲线:使用空白乌龙茶基质液配制校准曲线,浓度点与溶剂曲线相同。
1.5 色谱及质谱条件
1.5.1 色谱条件
色谱柱:Xbridge BEH C18色谱柱(100 mm×2.1 mm,
3.0 µm);进样体积:10 µL;流速0.5 mL/min;柱温:35 ℃;流动相为乙腈(A)-0.1%甲酸(B);等度洗脱程序:0.0~
5.0 min,75% A。
1.5.2 质谱条件
离子源:ESI源;离子化模式:电喷雾电离源正模式(ESI+);气帘气压:241 kPa;毛细管电压:5 500 V;离子源温度(TEM):550 ℃;雾化气压力:345 kPa;加热辅助气压力:345 kPa;碰撞气(CAD):中等;采集模式:多反应监测(MRM)模式。
2 结果与分析
2.1 定性定量分析依据的收集
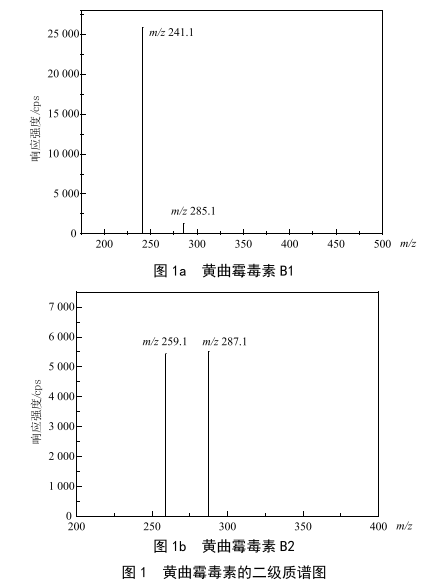
根据黄曲霉毒素B1和黄曲霉毒素B2的化学结构,其含有较多含O基团,在离子化过程中倾向于得到质子,因此分别以其相对分子质量加上H+质量,初步确定母离子质荷比。以混合流动相的流动注射的方式向离子源注射标准溶液,在/ 313.1和/ 315.1处,均得到较高响应的[M+H]+离子,同时以多反应监测(MRM)模式采集二级碎片。进一步优化去簇电压DP和碰撞电压CE,得到较优响应,二级质谱图见图1,详细质谱信息见表1。
2.2 分散剂的选择
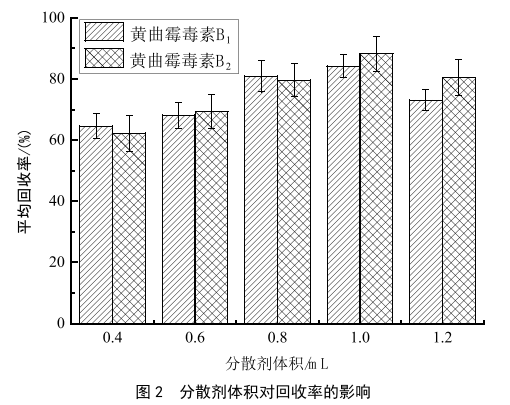
分散液液微萃取过程中,加入分散剂和待测样液互溶,加入萃取剂振荡形成微小的液滴,这些液滴在移动的过程中于对目标物进行连续萃取,形成水/分散剂/萃取剂形成均相乳浊液体系,快速完成分析物在水溶液与萃取剂之间的分配平衡。选择盐酸作为分散剂。在本实验中,当分散剂用量小于0.6 mL时,提取回收率低于70%,使用量为1.0 mL时,回收率达到最高,随着使用量提高至1.2 mL,回收率有所回降。所以盐酸分散剂用量选取为1.0 mL。详细结果见
2.3 萃取剂体积的选择
在分散剂体积为1 mL的条件下,分别用30 μL、
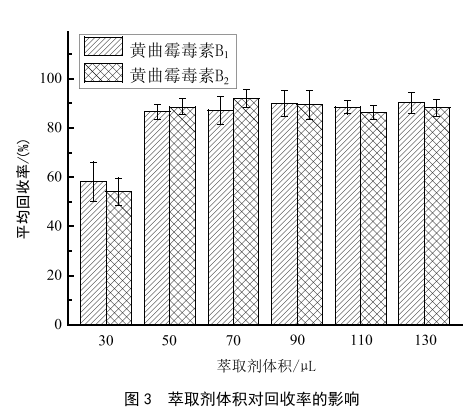
50 μL、70 μL、90 μL、110 μL和130 μL的3-氯苯胺进行萃取,考察了不同体积的萃取剂对萃取回收率的影响,结果如图3所示。随着3-氯苯胺体积增大,回收率也增大,而当体积大于50 μL时,回收率增大不明显,而且3-氯苯胺的使用体积越大,pH回调的幅度也越大,实验更耗时,最终定容液3-氯苯胺的占比也越大,对于含有甲酸的流动相体系,容易造成溶剂效应,使峰型变差。因此,最终确定3-氯苯胺50 μL为最佳萃取体积。
2.4 基质效应的探讨
市售的茶饮料会添加糖、色素、酸度调节剂或其他添加剂,且含量远超于黄曲霉毒素可能存在的含量,加上茶叶本身含有较多的天然物,因此有可能造成较严重的基质效应(ME),使定量结果偏差较大。为了探究实验实际存在的基质效应,分别用空白基质液和乙腈配制了基质曲线和纯溶剂曲线,并以基质曲线和纯溶剂曲线的斜率比值为判断依据,当ME在80%~120%时,则说明基质效应不明显。实验结果显示,黄曲霉毒素B1和黄曲霉毒素B2的值分别为23.2%和26.5%,说明基质负效应明显,因此最终选择使用基质曲线进行定量,以校正基质效应造成的偏差。
2.5 定量分析结果
使用空白基质溶液配制标准曲线,线性范围为1.0~100 µg/L,将该曲线于优化后的条件下测定,以质量浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。同时以信噪比/=3和信噪比/=10分别确定方法的检测限与定量限。黄曲霉毒素B1和黄曲霉毒素B2定量离子流图见图4。
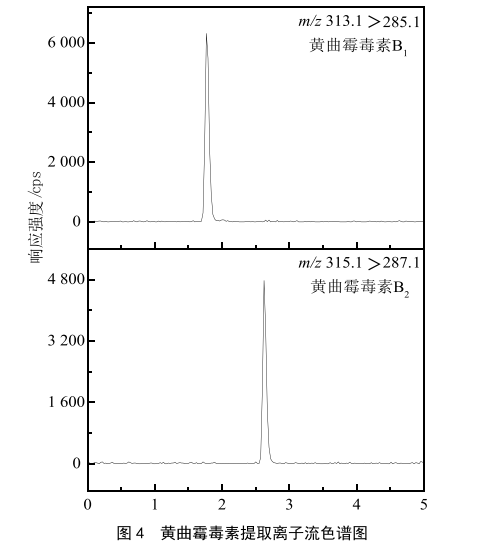
结果表明,黄曲霉毒素B1和黄曲霉毒素B2的相关系数分别为0.999 6和0.999 3,基质曲线方程分别为=5 050+
2 240和=3 090+2 750,检测限均为20.0 ng/kg,定量限均为50.0 ng/kg。由分析结果可知,本方法定量能力好,检出限低,可有效对茶饮料中的黄曲霉毒素进行定量分析。
2.6 回收率及精密度分析
分别对市售的3种茶饮料(绿茶、乌龙茶、红茶)进行测定,结果均为阴性。使用该样品进行加标回收实验。每种样品均按照定量限的1倍、2倍和10倍进行添加,即0.05 μg/kg、
0.10 μg/kg、0.50 μg/kg浓度水平,每个浓度水平在日内平均测定6次,平均回收率和相对标准偏差结果见表2。
3种样品的平均回收率范围在71.2%~91.0%,范围在2.23%~6.43%,方法回收率、精密度及准确度良好,可用于实际样品的测定。

3 结论
以液液微萃取为基础,建立前处理方法,方法整体高效简单,通过调节pH,较大限度回收萃取剂,提高了回收率;建立UPLC-MS/MS法,优化了色谱及质谱条件,两种黄曲霉毒素在样3 min内出峰,且峰型良好。使用基质曲线对定量结果进行校准,降低了基质效应对结果的影响。回收率和相对标准偏差数据表明,方法灵敏度高、重现性好,可为茶饮料中毒素测定方法的开发提供
依据。
参考文献
[1]潘中华,徐燕芳,成恒嵩.黄曲霉毒素分析方法进展[J].农业环境与发展,1995,12(2):30-33.
[2]赵亚荣,刘香香,赵晓丽,等.生姜及其制品中常见真菌毒素污染与检测方法研究进展[J].农产品质量与安全,2020(4):49-54.
[3]NAIR K P P.The Postharvest and industrial processing of ginger [M].Oxford: Elsevier,2013.
[4]杨惠宇,赵莹,潘发林.鱼类饲料中黄曲霉毒素B1检测技术研究进展[J].河北渔业,2020(8):52-55.
[5]OMOTAYO O P, OMOTAYO A O, BABALOLA O O, et al. Dataset on the toxic effects of aflatoxin and ochratoxin A on the human gastric smooth muscle cells[J].Data in Brief, 2019,25:104089.
[6]华丽霞,曾华兰,蒋秋平,等.免疫亲和净化-光化学衍生液相色谱检测不同样品中的黄曲霉毒素[J].中国农业科技导报,2020,22(7):181-187.
[7]石格鑫.高效液相色谱法测定小麦中黄曲霉毒素B1含量[J].现代食品,2020(10):204-206.
[8]孙夏荣,葛晓明,王建花.QuEChERS超高效液相色谱-串联质谱法检测中药饮片中黄曲霉毒素[J].中国药业,2020,29(11):44-47.
[9]华宇,高和杨,聂兴娜,等.同位素内标-高效液相色谱-串联质谱法检测牛奶及奶粉中黄曲霉毒素M1[J].食品安全质量检测学报,2020,11(6):1978-1984.
[10]姚婷,王丹,李双,等.超高效液相色谱-四极杆-飞行时间质谱法快速检测发酵黑茶中黄曲霉毒素B1[J].分析测试学报,2017,36(11):1346-1351.
[11]Iqbal J, Asghar M A, Ahmed A, et al. Aflatoxins contamination in Pakistani brown rice: a comparison of TLC, HPLC, LC-MS/MS and ELISA techniques[J]. Toxicol Mech Method, 2014,24(8):544-551.
[12]Juki H, Dedi S, Rodi M, et al. Determination of Aflatoxin M1 in Raw Milk by the ELISA Method in the Una-Sana Canton[M]. 30th Scientific-Experts Conference of Agriculture and Food Industry,2020.
作者简介:陈佩佩(1990—),女,广东茂名人,大专,助理工程师。研究方向:食品分析检测。
热点推荐
-

全十红红稗饼干|中秋团圆,回家必备
-

和汪氏蜂蜜共同来普及蜂蜜结晶现象
-

拿坡海开启西餐加盟新潮流, 大众化家庭小西餐成未来新趋势
-

摩购空间“霸王餐”来袭 打破传统营销套路带动商家业绩翻倍
-

开学季食安隐患猛增 禧云食安开展公益行动助力意识提升
-

分散液液微萃取-超高效液相色谱-串联质谱法测定茶饮料中黄曲霉毒
-

辣椒及其制品中辣椒素含量检测及辣度分级
-
火焰原子吸收光谱法测定食品中锌的方法验证
-
对硫磷等6种农药残留荧光免疫检测芯片的研发及应用
-

山东省潍坊市市售蔬菜中农药残留现况及慢性膳食暴露风险评估
-

食品检验检测机构质量控制的探讨
-
快速检测技术在食品安全中的应用研究进展
-
基于X射线图像的坚果盒异物检测
-
表面增强拉曼光谱法快速检测调味品中的百草枯
-
潞党参重金属污染物含量的评估
-
电位滴定法测定特殊医学用途食品中氯化物的不确定度评定
-
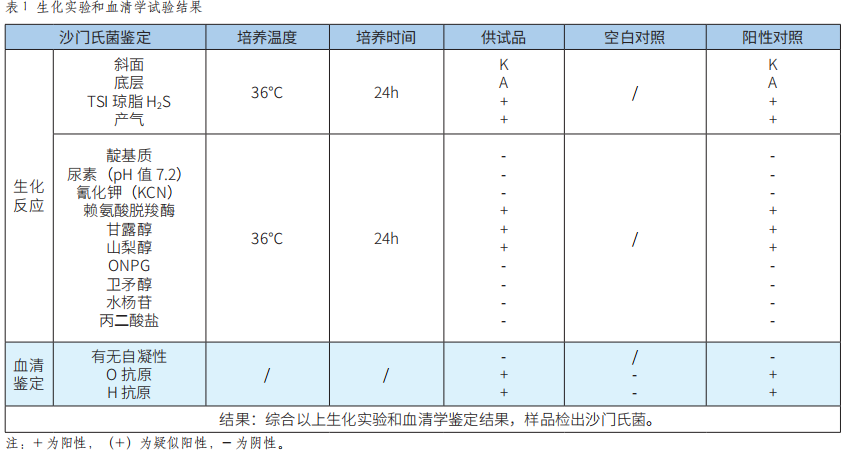
API 20E鉴定系统等两种检测方法应用于食品中沙门氏菌的检测结果
-

2020年上海市青浦区肉制品中单增李斯特菌分子分型及耐药性分析
-
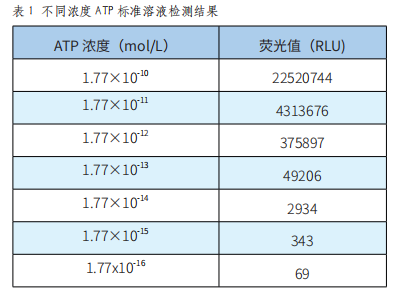
一种基于ATP荧光反应的洁净度检测系统的开发与验证
-
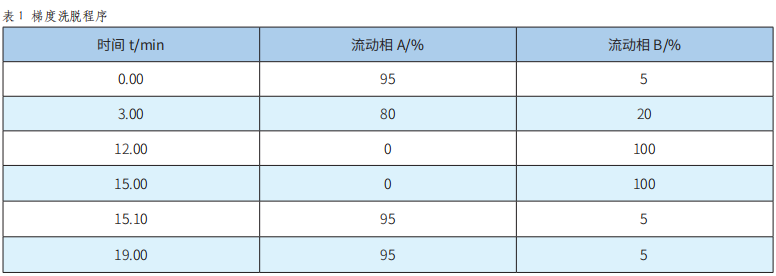
固相萃取-高效液相色谱-二极管阵列检测法测定饮料中9种人工合成着
-

一种检测盐霉素胶体金试纸条的研制及其应用
-

高效液相色谱法测定绿豆糕中5种常见的食品添加剂
-
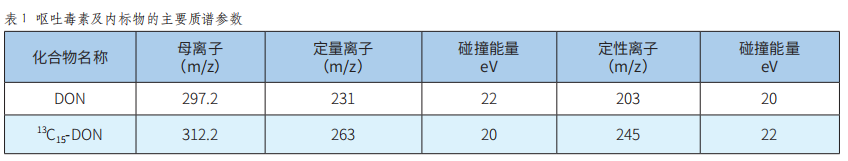
液相色谱-串联质谱内标法测定全麦粉中呕吐毒素含量的不确定度评
-
浅析QuEChERS方法结合色谱串联质谱技术在果蔬农药残留检测中的优势
-
食品检测技术问题及其解决措施研究
-
梅特勒-托利多最新版 ProdX™ 软件引入工业 4.0 功能
-
气相色谱-质谱法测定曼陀罗药酒中莨菪碱的含量
-

食品中鸡源性成分标准检测方法的比较性研究
-
基于银沉积的微间隙阵列电极检测盐酸克伦特罗的方法研究
-
2019年榆林市监督抽检馃馅与糖琪子的酸价、过氧化值检测结果分析





