电位滴定法测定特殊医学用途食品中氯化物的不确定度评定
2021-05-27 11:23:19 来源: 食品安全导刊
□ 刘晓娟 王巧娟 张繁繁 马瑞雪 西安力邦临床营养股份有限公司
摘 要:参照《食品安全国家标准 食品中氯化物的测定》(GB 5009.44-2016)第一法 电位滴定法来测定特殊医学用途食品中氯化物的含量,并对测定结果的不确定度来源和测量不确定度的影响进行了分析。同时,通过对相对标准不确定度的分步计算与合成进行了测定结果的不确定度评定。关键词:氯化物 不确定度 电位滴定法
氯是人体内不可或缺的常量元素之一,其可以维持体液和电解质的平衡,也是胃液中一种必不可少的组成成分。人体内氯的平均含量为1.17g/kg,主要以氯化钠、氯化钾等形式存在。通常情况下,氯的缺少会伴随着钠的缺乏,从而造成低氯性代谢性碱中毒,常见症状有肌肉收缩不良、消化道受损等。尽管如此,人体内的氯元素也不能过量,否则将会对身体造成不同程度的伤害[1]。
1 测量方法[2]
1.1 测量原理
参考《食品安全国家标准 食品中氯化物的测定》(GB 5009.44-2016)第一法 电位滴定法:氯离子与银离子反应后生成氯化银沉淀,以玻璃电极为参比电极、银电极为指示电极,用硝酸银标准滴定溶液法滴定试液中的氯化物。然后,利用硝酸银标准滴定溶液的使用量计算出食品中的氯含量。
1.2 测量仪器和方法
1.2.1 仪器
电位滴定仪、恒温水浴锅、超声波清洗仪、高速离心机、电子天平(0.1mg)。
1.2.2 方法
称取混合均匀的试样5g(精确至0.01mg)置于50mL容量瓶中,加入40mL约70℃热水,振荡分散样品,水浴中沸腾加热15min并不定时晃动。之后取出并超声20min,取出冷却至室温,依次加入2mL亚铁氰化钾溶液和2mL乙酸锌溶液,每次添加后摇匀。用水定容至刻度,摇匀,取部分溶液于离心管中,放置于离心机离心(5000r/min)10min。用移液管移取10.00mL上清液置于50mL测量杯中,加入5mL硝酸溶液(1+3)和25mL丙酮。用电位滴定仪滴定,记录硝酸银标准滴定溶液消耗的体积。同时,做空白试验。
氯化钠基准溶液(0.01000mol/L):称取0.5844g(精确至0.1mg)经500℃恒重的氯化钠(基准试剂)置于小烧杯中,用少量水溶解,转移到1000mL容量瓶中,用水定容至刻度,摇匀,转移到瓶中贮存。
硝酸银标准滴定溶液(0.02mol/L):称取1.70g硝酸银(精确至0.01g)置于小烧杯中,用少量硝酸溶解,转移到500mL棕色容量瓶中,然后用水定容至刻度,摇匀,再转移到棕色瓶中避光贮存。
硝酸银溶液的标定:吸取0.01000mol/L氯化钠基准溶液10.00mL置于50mL测量杯中,加入0.2mL硝酸溶液和25mL丙酮,放置好转子。设置好电位滴定仪的参数,将电极浸入溶液中,启动电位滴定仪。滴定终止后,记录消耗的硝酸银溶液的体积。
1.3 数学模型
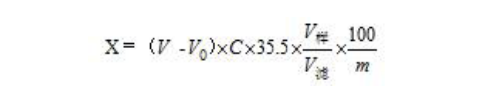
式中:X为样品中氯的含量(mg/100g),V为样品测定液消耗硝酸银的体积(mL),V0为空白测定液消耗硝酸银的体积(mL),C为硝酸银标准滴定液的浓度(mol/L),35.5为氯的相对分子质量(g/mol),m为样品的称样质量(g),V样为样品定容体积(mL),V滤为样品测定液的体积(mL)。
2 测量不确定度的来源分析和计算[3-4]
2.1 制样引入的不确定度分量
因为样品是混合均匀的粉剂产品,所以取样引入的不确定度可忽略不计。
称样过程:在天平(Practum®)上称量5.0000g引入的不确定度,假定取其为矩形分布。
通过天平使用说明书查询到天平线性为±0.002g,即
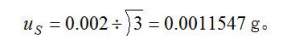
通过天平使用说明书查询到天平重复性标准偏差0.0001g,即
则
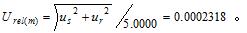
样品需经过50mL容量瓶定容和10mL分度吸管移取,20℃时50mL的A类容量瓶允差为±0.05mL,10mL的A类分度吸管允差为±0.05mL[5],假定取其为三角分布。
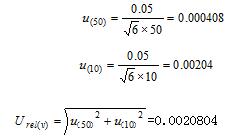
实验室温度常在(20±5)℃之间波动,玻璃器皿校准温度通常为20℃,水的膨胀系数为2.1x10-4/℃[6],相比之下玻璃的膨胀系数可忽略不计。实验过程中用到50mL容量瓶和10mL移液管,假定取其为矩形分布。
因此样品制备过程中的不确定度为:
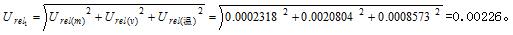
2.2 标准滴定液浓度引入的标准相对不确定度分量
硝酸银标准滴定溶液的浓度由基准试剂氯化钠计算所得,因此可直接对基准试剂氯化钠进行相关的不确定度评定。
硝酸银标准溶液的滴定:烘干恒重的氯化钠溶解于1000mL无二氧化碳的去离子水中。
称量不确定度:用天平称样0.5844g引起的不确定度,假定取其为矩形分布。
天平线性为±0.002g,即
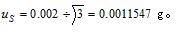
重复性标准偏差为0.0001g,
 即
即则

基准试剂氯化钠的纯度为99.95%~100.05%,取k=2,则其标准不确定度为:
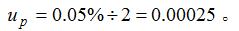
定容时容量瓶引入的不确定度:1000mL的A类容量瓶允差为±0.40mL[2],假定取其为三角分布。

则标准滴定液浓度引人的标准相对不确定度分量为:
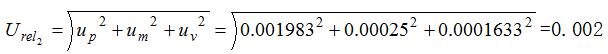
2.3 检测过程中随机性引入的标准相对不确定度分量
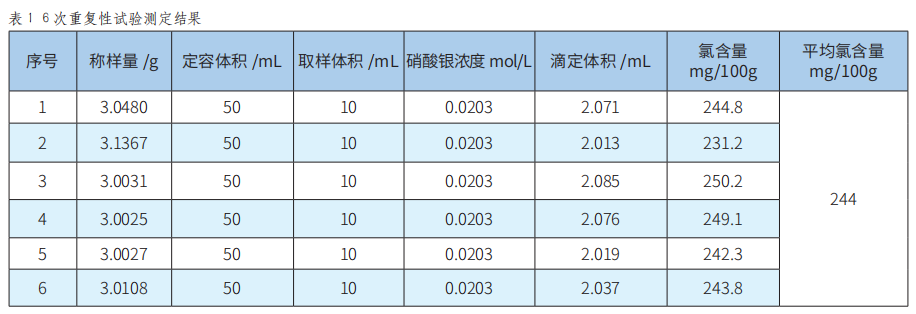
取同一样品进行6次重复性试验,空白滴定体积为0.000mL,其测定结果见表1。
标准偏差为:
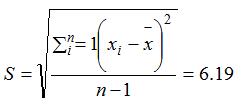
检测过程中随机性引入的标准相对不确定度为:
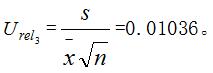
2.4 电位滴定仪引入的标准相对不确定度分量
电位滴定仪中的毫伏计精度为0.1mV,假定取其为矩形分布,则相对标准不确定度为:
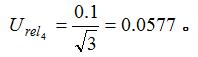
2.5 合成标准相对不确定度

2.6 扩展不确定度U
2.6.1 相对扩展不确定度u
取k=2,
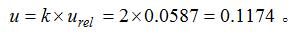
2.6.2 扩展不确定度U

则样品中氯含量可表示为244±28.6456mg/100g。
3 结论
本文对电位滴定法测定特殊医学用途食品中的氯化物含量的不确定度进行了分析。结果表明,实验过程中的样品制备、标准滴定溶液配制、测样过程的随机性、仪器本身等都会引入不确定度。其中,电位滴定仪精度引入的不确定度最大,其次为测量随机性产生的不确定度,再次为样品制备过程产生的不确定度,最后为标准滴定溶液产生的不确定度。因此,在检测过程中需不断完善存在的问题,提高检测结果的稳定性。
参考文献:
[1] 葛可佑.中国营养科学全书上册[M].北京:人民卫生出版社,2004.9.
[2] 《食品安全国家标准 食品中氯化物的测定》(GB 5009.44-2016)[S].
[3] 《测量不确定度评定与表示》(JJF 1059.1-2012)[S].
[4] 《化学分析中不确定度的评估指南》(CNAS-GL06-2006)[S].
[5] 《常用玻璃量器》(JJG l96-2006)[S].
[6] 马利云.稻谷脂肪酸值测定结果的不确定度评定[J].粮食储藏,2011(5).
热点推荐
-

全十红红稗饼干|中秋团圆,回家必备
-

和汪氏蜂蜜共同来普及蜂蜜结晶现象
-

拿坡海开启西餐加盟新潮流, 大众化家庭小西餐成未来新趋势
-

摩购空间“霸王餐”来袭 打破传统营销套路带动商家业绩翻倍
-

开学季食安隐患猛增 禧云食安开展公益行动助力意识提升
-
潞党参重金属污染物含量的评估
-
电位滴定法测定特殊医学用途食品中氯化物的不确定度评定
-
API 20E鉴定系统等两种检测方法应用于食品中沙门氏菌的检测结果
-

2020年上海市青浦区肉制品中单增李斯特菌分子分型及耐药性分析
-
一种基于ATP荧光反应的洁净度检测系统的开发与验证
-
固相萃取-高效液相色谱-二极管阵列检测法测定饮料中9种人工合成着
-

一种检测盐霉素胶体金试纸条的研制及其应用
-

高效液相色谱法测定绿豆糕中5种常见的食品添加剂
-
液相色谱-串联质谱内标法测定全麦粉中呕吐毒素含量的不确定度评
-
浅析QuEChERS方法结合色谱串联质谱技术在果蔬农药残留检测中的优势
-

食品检测技术问题及其解决措施研究
-
梅特勒-托利多最新版 ProdX™ 软件引入工业 4.0 功能
-
气相色谱-质谱法测定曼陀罗药酒中莨菪碱的含量
-

食品中鸡源性成分标准检测方法的比较性研究
-
基于银沉积的微间隙阵列电极检测盐酸克伦特罗的方法研究
-
2019年榆林市监督抽检馃馅与糖琪子的酸价、过氧化值检测结果分析
-

超高效液相色谱法测定秋葵籽油中苯并芘的含量
-

咸阳市2019年监督抽检小麦粉中过氧化苯甲酰的检测分析
-
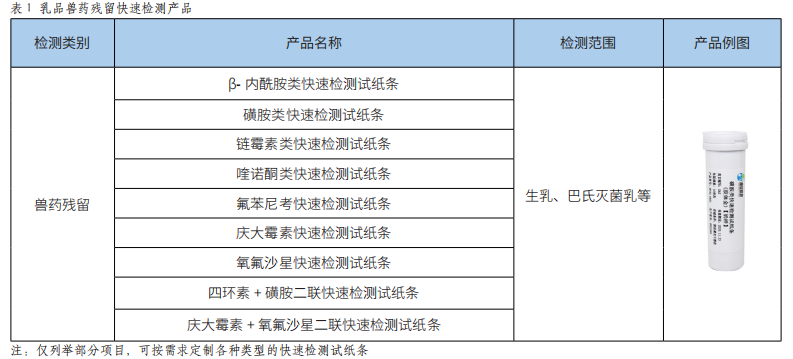
快速检测技术助力生鲜乳及巴氏杀菌乳的质量控制
-

优化液质联用法对氟喹诺酮类药物残留的检测
-
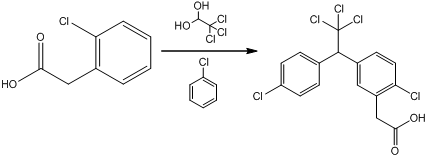
一种滴滴涕胶体金免疫快速检测试纸条的研制
-

一种甲氨基阿维菌素胶体金免疫快速检测试纸条的研制
-

超高效液相色谱-串联质谱法测定辣椒油中的溶剂红52
-

真菌毒素检测中的误差来源和控制
-

打击食品欺诈:用NMR检测蜂蜜掺假





