食品中鸡源性成分标准检测方法的比较性研究
2021-02-26 17:04:43 来源: 食品安全导刊
□ 王莹 尚亚宁 邹寒艳 张伶俐(通信作者) 重庆市食品药品检验检测研究院
摘 要:为比较食品中鸡源性成分的标准检测方法,本试验对3种标准检验的引物计、方法及灵敏度进行比较。结果显示,实时荧光PCR法引物特异性好、方法简便、灵敏度高。因此得出结论,两种实时荧光PCR法均可作为鸡源性成分检测的补充方法。关键词:肉制品 实时荧光PCR 鸡源性成分
肉类是人体重要的营养来源,与人们的生活息息相关,肉制品的质量安全已成为备受关注的热门话题。目前,肉制品市场仍然存在“以次充好、掺杂使假”的现象,如不法企业用大量相对廉价的鸡肉、鸭肉掺杂少量的牛羊脂肪、骨粉等,然后通过各种深加工手段来冒充牛羊肉以牟取高额利益,这不仅侵害了消费者的权益,更会直接影响消费者的健康。随着国家食品安全监管体系的完善,仅靠感官评价来鉴别肉类真伪的传统形式已不能满足对肉制品掺假的监控需求。
为满足市场监管和消费者的需要,对食品中动物源性成分进行鉴定已成为越来越多研究者关注的热点[1]。目前,我国建立了一系列基于PCR技术的动物源性成分检测的国家标准和行业标准[2-3],但是有关畜禽肉中鸡源性成分检测的研究报道较少[4]。现行的行业标准《动物源性产品中鸡源性成分PCR检测方法》(SN/T 2978-2011)[5]中采用传统PCR后电泳染色的方法,其灵敏度较低,需要电泳和测序,操作复杂,且电泳所用的核酸染料会对环境造成污染。因为实时荧光PCR在灵敏度、准确度、便捷性方面均高于普通PCR,所以本研究主要针对两种检测鸡源性成分的实时荧光PCR法与现行标准方法进行比较,旨在为后续鸡源性成分的检验工作提供补充检验方法,并为监管部门提供更有力的技术支持。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
新鲜鸡肉,购自重庆市本地超市;DNA提取试剂盒:TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0,实时荧光PCR DNA检测试剂盒:TaKaRa Premix Ex Taq™ (Probe qPCR),琼脂糖,DNA Marker,均购自TaKaRa公司;2×Power Taq PCR Master Mix,购自百泰克公司。
1.1.2 仪器
Tprofessional PCR仪,德国Biometra公司;Lightcycler 480 II荧光定量PCR仪,瑞士Roche公司;NANO DROP ONE微量核酸分析仪,Thermo公司;Tanon-4500SF凝胶成像系统,上海天能公司。

1.2 实验方法
1.2.1 DNA提取
将新鲜鸡肉搅碎至肉糜状,参照试剂盒说明书提取DNA,然后用微量核酸分析仪测定浓度,并于-20℃保存备用。
1.2.2 PCR扩增
引物与探针由华大基因合成,方法1为SN/T 2978-2011,方法2为SZDB/Z 267-2017[6],方法3为SB/T 10923-2012[7],3种方法的PCR反应体系、扩增程序及引物探针序列信息详见表1。
1.2.3 3种方法灵敏度的比较
将鸡肉的DNA浓度分别稀释至200、100、10、1ng/μL及100、10、1、0.1pg/μL这8个梯度,并用3种方法进行试验。
2 结果与讨论
2.1 样品基因组DNA提取
新鲜鸡肉未经过深加工,故富含大量且完整的DNA,易于提取。按照试剂盒说明书进行操作,提取鸡肉DNA浓度为325.8ng/μL,A260/280为1.89,DNA纯度高、质量较好,可以满足后续PCR检测需求。
2.2 3种方法的引物比对结果
将3种方法的引物在NCBI进行比对分析,3种引物的模板来源均为鸡线粒体,但不位于同一个基因;3种模板序列的同源性为45.48%,参见图1。

2.3 3种方法PCR扩增结果
2.3.1 普通PCR
按照方法1进行PCR扩增,未能扩增出单一DNA条带,将引物浓度扩大10倍、100倍和1000倍,结果在将引物浓度扩大1000倍,即引物浓度为10μmol/L时能扩增出阳性条带。对阳性条带进行测序,其片段大小正确,且与鸡线粒体DNA相对应片段的序列同源性为100%,结果见图2中A和D。
2.3.2 荧光定量PCR
运用方法2和方法3进行扩增,阴性对照和空白对照均未出现扩增曲线。方法2的阳性对照和样品有典型的扩增曲线,循环数(Ct值)分别为12.735和16.78;方法3的阳性对照和样品有典型的扩增曲线,循环数(Ct值)分别为12.225和16.69,检测结果见图2中B和C。

图 2 3 种方法检验结果
方法1为普通PCR法,在DNA浓度为10ng/μL时可以扩增出阳性条带,该方法的灵敏度为10ng/μL。方法2和方法3为荧光定量PCR,方法2在DNA浓度为1pg/μL时,Ct值为36.64,当Ct值大于35时,重复实验有可能会出现阴性结果,故该方法的灵敏度应为10pg/μL;方法3在DNA浓度为0.1pg/μL时,Ct值为36.91,故方法3的灵敏度应为1pg/μL。由此可见,荧光定量PCR的灵敏度远远高于普通PCR,结果见图3。

图 3 3 对引物模板同源性比较
近年来,以物种DNA为鉴定基础的PCR技术已经被广泛用于动物源性成分的鉴别[8-10],而高质量、高纯度及结构完整的基因组DNA是影响PCR扩增的重要因素,故快速、稳定、优质的DNA提取方法将是PCR扩增成功的关键。目前,国内外研究发现并使用动物肌肉组织DNA的提取方法有很多,其中较常使用的包括SDS法、异硫氰酸胍法[11]、试剂盒法[12],以及一些以SDS法为基础的改良方法[13]。根据刘娜等对于动物肌肉组织DNA提取方法的比较,发现试剂盒法操作简单、快速、安全,提取DNA的纯度、浓度及稳定性均优于其他方法[14],所获得的核酸样本可以在低温条件下储存以便复核,且各实验室间比对差异较小,故本试验采用试剂盒法提取DNA。
因为线粒体DNA是高等动物唯一的核外遗传物质,所以本研究中3个标准检测方法均采用鸡线粒体DNA作为靶基因设计特异性引物。线粒体DNA主要以编码序列构成,基因组序列具有高度物种特异性,种内的异质基因较少[15],且拷贝数较多,在食品加工过程中未完全降解,而动物组织细胞中均含有大量的线粒体[16]。因此,动物线粒体DNA是一个较为理想的可用于动物源性成分鉴别的良好靶基因[17-19]。
PCR技术的发展为动物源性成分的鉴别提供了有效途径,实时荧光PCR技术凭借其特异性好、检测周期短、灵敏度高等优势,提高了食品中动物源性成分鉴别的准确性,应用前景广阔。目前,检测猪、牛、羊、马、驴等动物源性成分的行业标准均采用实时荧光PCR法。现行检测鸡源性成分的行业标准为普通PCR法,方法中提供的引物浓度不能达到检测需求。此外,普通PCR还具有较大的局限性,如对检测样品的形态要求较高,若样品为深加工食品或血制品,则其中所含DNA可能无法满足检测需求而更易出现假阴性结果[20],且该方法需要测序,过程较为繁琐,耗时较长。因此,研究建立快速、高效、准确的鸡源性成分的检测方法尤为重要。本研究通过比较3种标准检验方法,结果表明,实时荧光PCR法较普通PCR法更加简便快速,可以应用于日常食品中鸡源性成分的检测,帮助监管部门提高对肉制品的管控力度,保障人民的食品安全,促进肉类产业健康发展。
参考文献:
[1] 李晶,杨成.5种常见加工肉制品的DNA 提取方法比较以及猪源性成分检测[J].食品工程,2019,(2):56-60.
[2] 《饲料中禽源性成分检测方法 实时荧光 PCR方法》(SN/T 2727-2010)[S].
[3] 《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时PCR法》( GB/T 2051-2008)[S].
[4] 唐修君,樊艳凤,贾晓旭,等.荧光 PCR 法检测畜禽肉中的鸡源性成分[J].现代食品科技,2018,34(7)230-234.204.
[5] 《动物源性产品中鸡源性成分PCR检测方法》(SN/T 2978-2011)[S].
[6] 《肉食品中鸡源性成分实时荧光PCR检测方法》(SZDB/Z 267-2017)[S].
[7] 《肉及肉制品中动物源性成分的测定实时荧光PCR法》(SB/T 10923-2012)[S].
[8] 周正,吕二盼,周巍,等.动物源性食品鸭血、猪血DNA 提取方法研究及双重PCR检测[J].食品工业,2012(33):161-166.
[9] 钟伟军,陈金顶.PCR检测饲料中牛源组织成分的研究[J].华南农业大学学报,2006,27(3):33-36.
[10] 汪永信,安虹,程坚,等.双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J].生物技术通报,2012(1):134-138.
[11] 徐伟丽,杜明,李启,等.动物肌肉组织基因组DNA两种提方法的比较[J].食品工业科技,2011,32(12):81-84.
[12] 杨利丽,刘红英,杨和军,等.一种改进的异硫氰酸胍法结合硅胶膜离心吸附柱提取孕妇外周血微量胎儿RNA的方法[J].中国生物化学与分子生物学报,2012(2):177-181.
[13] 高丹丹,陈燕,王迎华,等.动物肉制品基因组DNA的提取和纯化[J].食品科技,2007(8):42-44.
[14] 刘娜,赵新,陈锐,等.动物肌肉组织DNA的提取方法及实时荧光定量PCR检测[J].食品工业科技,2016,37,(18):74-80.
[15] Momcilovic D, Rasooly A. Detection and analysis of animal materials in food and feed. Journal of Food Protection,2000, 63: 1602-1609.
[16] Tartaglia M, Saulle E, Pestalozza S, Morelli L, Antonucci G, Battaglia P A. Detection of bovine mitochondrial DNA in ruminant feeds: amolecular approach to test for the presence of bovine-derived materials. Journal of Food Protection, 1998, 61: 513-518.
[17] BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination: can we detect and quantify meat adulteration [J]. Meat Science, 2009, 83(2): 165-174.
[18] 何玮玲,张驰,杨静,等.食品中4种肉类成分多重PCR的快速鉴别方法[J].中国农业科学,2012,45(9):1873-1880.
[19] 张晶鑫,樊艳凤,唐修君,等.基于线粒体DNA 16S rRNA基因鉴别畜禽肉中鸭源性成分研究[J].中国家禽,2016,38(17):41-44.
[20] 徐慧,马慧娟.动物源性食品鸭血中鸭成分普通PCR检测方法探究[J].食品安全导刊,2018(03):60-61.
作者简介:王莹(1990.10-),女,汉族,籍贯山东,硕士研究生;研究方向:食品药品检测;工作单位:重庆市食品药品检验检测研究院。
热点推荐
-

全十红红稗饼干|中秋团圆,回家必备
-

和汪氏蜂蜜共同来普及蜂蜜结晶现象
-

拿坡海开启西餐加盟新潮流, 大众化家庭小西餐成未来新趋势
-

摩购空间“霸王餐”来袭 打破传统营销套路带动商家业绩翻倍
-

开学季食安隐患猛增 禧云食安开展公益行动助力意识提升
-

食品中鸡源性成分标准检测方法的比较性研究
-
2019年榆林市监督抽检馃馅与糖琪子的酸价、过氧化值检测结果分析
-

超高效液相色谱法测定秋葵籽油中苯并芘的含量
-

咸阳市2019年监督抽检小麦粉中过氧化苯甲酰的检测分析
-
快速检测技术助力生鲜乳及巴氏杀菌乳的质量控制
-

优化液质联用法对氟喹诺酮类药物残留的检测
-
一种滴滴涕胶体金免疫快速检测试纸条的研制
-

一种甲氨基阿维菌素胶体金免疫快速检测试纸条的研制
-

超高效液相色谱-串联质谱法测定辣椒油中的溶剂红52
-

真菌毒素检测中的误差来源和控制
-

打击食品欺诈:用NMR检测蜂蜜掺假
-

金黄色葡萄球菌检验技术介绍及分析
-
市售食盐中亚铁氰化钾含量的测定
-

包装饮用水中微生物快速检测的必要性分析
-

MALDI Biotyper®提高了中国工业微生物菌种保藏中心微生物鉴定
-
基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性
-

安捷伦携手华大智造,共同推动实验室信息化系统与测序平台深度结
-
全自动在线免疫亲和固相萃取-液相色谱法快速定量检测植物油中的
-
基于酵母测试片促生长因子的研究
-
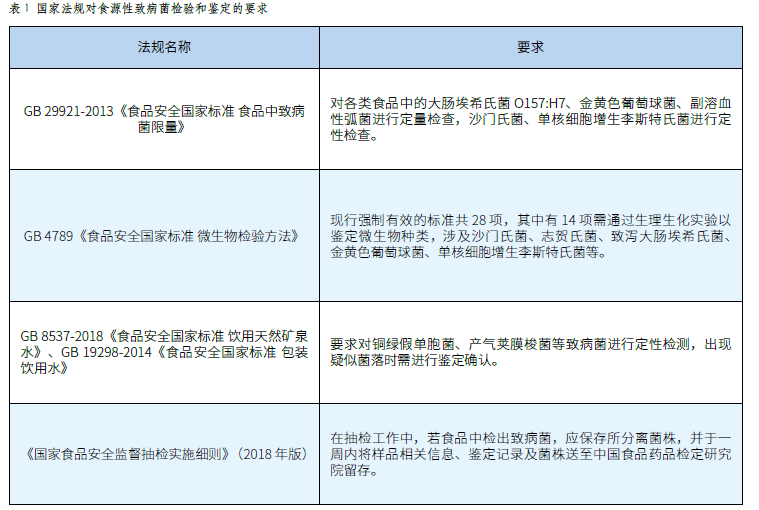
致病菌检验和鉴定技术在食品安全保障中的应用
-

多方共建高效检测体系,让真菌毒素无处遁形
-

安捷伦在BCEIA2019上展示创新产品和服务
-

非洲猪瘟的快速检测——速芯科技
-
气相色谱-质谱法测定食品中3-乙酰基-2,5-二甲基噻吩的含量
-

副溶血性弧菌的特征、分布及其致病风险评估研究概述





