基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性
2020-03-31 15:50:59 来源: 食品安全导刊
基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性食品中19种氟喹诺酮类抗生素残留
□ 王婷 锡林郭勒盟食品药品检验检测中心
□ 陈明涛 锡林郭勒食品药品检验检测和风险评估中心
摘 要:本文的目的是建立动物源性食品中19种氟喹诺酮类抗生素残留量的检测方法,样品经EDTA-Mcllvaine缓冲液提取、PEP固相萃取柱净化,通过Thermo Fisher Hypersil Gold C18(内径100×2.1mm,粒径1.7μm)进行分离,再用0.2%甲酸水溶液和甲醇乙腈溶液(体积比为40∶60)洗脱体系分离目标化合物,将目标化合物的保留时间、前体离子、子离子碎片及其相对丰度作为定性依据,选择响应稳定性好、信号强的子离子碎片作为定量离子,基质外标法定量。结果表明,19种氟喹诺酮类药物在2~100ng/mL范围内线性关系良好,相关系数均大于0.995;加标回收率在60%~120%,相对标准偏差均<20%。因此判定,该方法操作简单、灵敏度高、重现性好,符合动物源性食品中多种氟喹诺酮类残留量的检测要求。
关键词:多反应监测 氟喹诺酮 动物源性食品 超高效液相色谱-串联质谱联用
氟喹诺酮类抗生素药物的发展历史可以追溯到50多年前[1]。氟喹诺酮类药物(Fluoroquinolones,FQs)是人工合成抗菌药[2-4],又称吡啶酸类、沙星类药物,是喹诺酮药物的第三代发展产物,主要包括恩诺沙星(Enrofloxacin)、诺氟沙星(Norfloxacin)、培氟沙星(Pefloxacin)、环丙沙星(Ciprofloxacin)、氧氟沙星(Ofloxacin)、沙拉沙星(Sarafloxacin)、依诺沙星(Enoxacin)、洛美沙星(Lomefloxacin)、吡哌酸(Pipemidic acid)、萘啶酸(Nalidixic acid)、奥索利酸(Oxolinic acid)、氟甲喹(Flumequine)、西诺沙星(Cinoxacin)、单诺沙星(Danofloxacin,又名丹诺沙星、达氟沙星)、马波沙星(Marbofloxacin)、氟罗沙星(Fleroxacin)、奥比沙星(Orbifloxacin)、司帕沙星(Sparfloxacin)、双氟沙星(Difloxacin)等。氟喹诺酮类药物具有抗菌、抗支原体、抗球虫等作用,可有效预防和治疗动物泌尿生殖系统疾病、胃肠疾病,以及呼吸道、皮肤组织的感染性疾病,价格低、疗效好[2]。但是,此类药物在被广泛用于畜牧业养殖、加工贮存的过程中必然会造成动物源性食品中(如肉制品、牛奶、鸡蛋等)该类抗生素药物的残留[5-10],人们长期食用此类食品可能导致身体出现细菌耐药性、过敏、中毒、致癌、致畸、致突变等严重伤害[11-14]。
近年来,由于部分养殖户和经营者为了躲避食品抽查而不断变换或更新氟喹诺酮类抗生素的使用品种,致使动物源性食品中该类抗生素残留超标问题时有发生,针对这一现象,扩大此类抗生素检测范围的探索应与时俱进。本文旨在建立超高效液相色谱-质谱联用法以同时检验出动物源性食品中19种氟喹诺酮类抗生素的残留量,优化检验方法、提高检验效率、扩大检验范围,以期为在动物源性食品中开展多种抗生素残留的检测提供参考。
1 试验部分
1.1 仪器与试剂
仪器:Thermo TSQ QUANTUM ULTRA超高效液相色谱-三重四极杆质谱联用仪(美国Thermo Fisher科技公司)、台式高效冷冻离心机(盐城市安信实验设备有限公司)、多管涡旋混合均质器(美国Thermo Fisher科技公司)、真空过柱装置(天津市津腾实验设备有限公司)、氮吹仪(天津恒奥科技发展有限公司)、百分之一电子天平(奥豪斯)、PEP固相萃取柱(200mg、6mL,博纳艾杰尔)。
试剂:Quinolone Mix19(100μg/mL):Enrofloxacin、Norfloxacin、Pefloxacin、Ciprofloxacin、Ofloxacin、Sarafloxacin、Enoxacin、Lomefloxacin、Pipemidic acid、Nalidixic acid、Oxolinic acid、Flumequine、Cinoxacin、Danofloxacin、Marbofloxacin、Fleroxacin、Orbifloxacin、Sparfloxacin、Difloxacin,均购自BEIJING MANHAGE BIO-TECH(编号C0006319);供试试剂有乙腈、甲醇、甲酸,均为HPLC级;氢氧化钠、柠檬酸、乙二胺四乙酸二钠、磷酸氢二钠均为优级纯;实验用水为屈臣氏蒸馏水。
样品:市售猪肉20份、羊肉20份、鸡肉10份、鸡蛋10份、牛奶10份。
1.2 试验方法
1.2.1 提取
称取试样5.00g(精确到0.01g)置于50mL聚丙烯离心管中,加入15mL 0.1mol/L EDTA-Mcllvaine缓冲液,2500r/min涡旋混合1min,低温(温度低于20℃)超声提取10min,10000r/min离心10min(温度低于5℃),取上清液。提取3次,合并上清液,EDTA-Mcllvaine缓冲液定容至50mL。
1.2.2 净化
PEP固相萃取柱,使用前用6mL甲醇、6mL水进行活化。将10mL提取溶液以2~3mL/min的速度过柱,用2mL 5%甲醇淋洗,弃去淋洗液;小柱真空负压抽干(时间大于20min),再用6mL甲醇洗脱并收集洗脱液;洗脱液于40℃下使用氮气吹至近干,用1mL 0.2%甲酸水溶液溶解,旋涡混合1min,过0.22μm滤膜,上机待测。
1.3 基质标曲制备
1.3.1 混合标准储备液(10μg/mL)
精密吸取19种混合标准物质各1.00mL置于10mL容量瓶中,用甲醇定容至刻度,摇匀备用。
1.3.2 混合标准中间溶液(1μg/mL)
精密吸取混合标准储备液1mL置于10mL容量瓶中,用甲醇定容至刻度,摇匀备用。
1.3.3 混合标准工作溶液(100ng/mL)
精密吸取混合标准中间溶液1mL,置于10mL容量瓶中,用甲醇定容至刻度,摇匀备用。
1.3.4 基质标准工作曲线
分别使用不含氟喹诺酮类药物的猪肉、羊肉、鸡肉、鸡蛋、牛奶作为空白基质。准确称取阴性试样5.00g(精确至0.01g)置于50mL聚丙烯塑料离心管中,分别加入不同体积的19种氟喹诺酮类混合标准工作溶液,然后加入EDTA-Mcllvaine缓冲溶液,在涡旋混合器上混合均匀,同样品前处理及净化步骤,待吹至近干后,用初始比例流动相溶液定容配制成浓度分别为2、5、10、20、100ng/mL的标准系列。
1.4 仪器条件
1.4.1 色谱条件
色谱柱:Thermo Fisher Hypersil Gold C18(内径100×2.1mm、粒径1.7um);柱温:40℃;进样体积5μL;流速0.2mL/min;流动相A:0.2%甲酸水溶液,流动相B:甲醇-乙腈溶液(体积比为40∶60)。梯度洗脱条件见表1。
1.4.2 质谱条件
ESI正离子模式,喷雾电压3.5kV,蒸发温度350℃,离子传输管温度350℃,鞘气(N2)流量30arb,辅助气(N2)10arb。
2 结果分析
2.1 方法优化
2.1.1 样品制备
分别采用EDTA-Mcllvaine缓冲溶液和1%甲酸乙腈来提取猪肉、羊肉、牛奶中的19种氟喹诺酮类化合物,发现其虽然沉淀蛋白效果较好,但会因提取到更多的磷脂而严重干扰出峰时间较晚的Cinoxacin、Oxolinic acid、Nalidixic acid和Flumequine,且加标回收率偏低。
采用EDTA-Mcllvaine缓冲溶液提取的样品提取液在过PEP固相萃取柱时均出现了不同程度的堵塞情况,故实验对比了过滤样品提取液、分取样品提取液和钨酸钠-硫酸沉淀样品提取液3种方法解决净化柱堵塞问题。结果表明,分取样品提取液过PEP固相萃取柱实验效率高,处理的样品干净,回收率高。
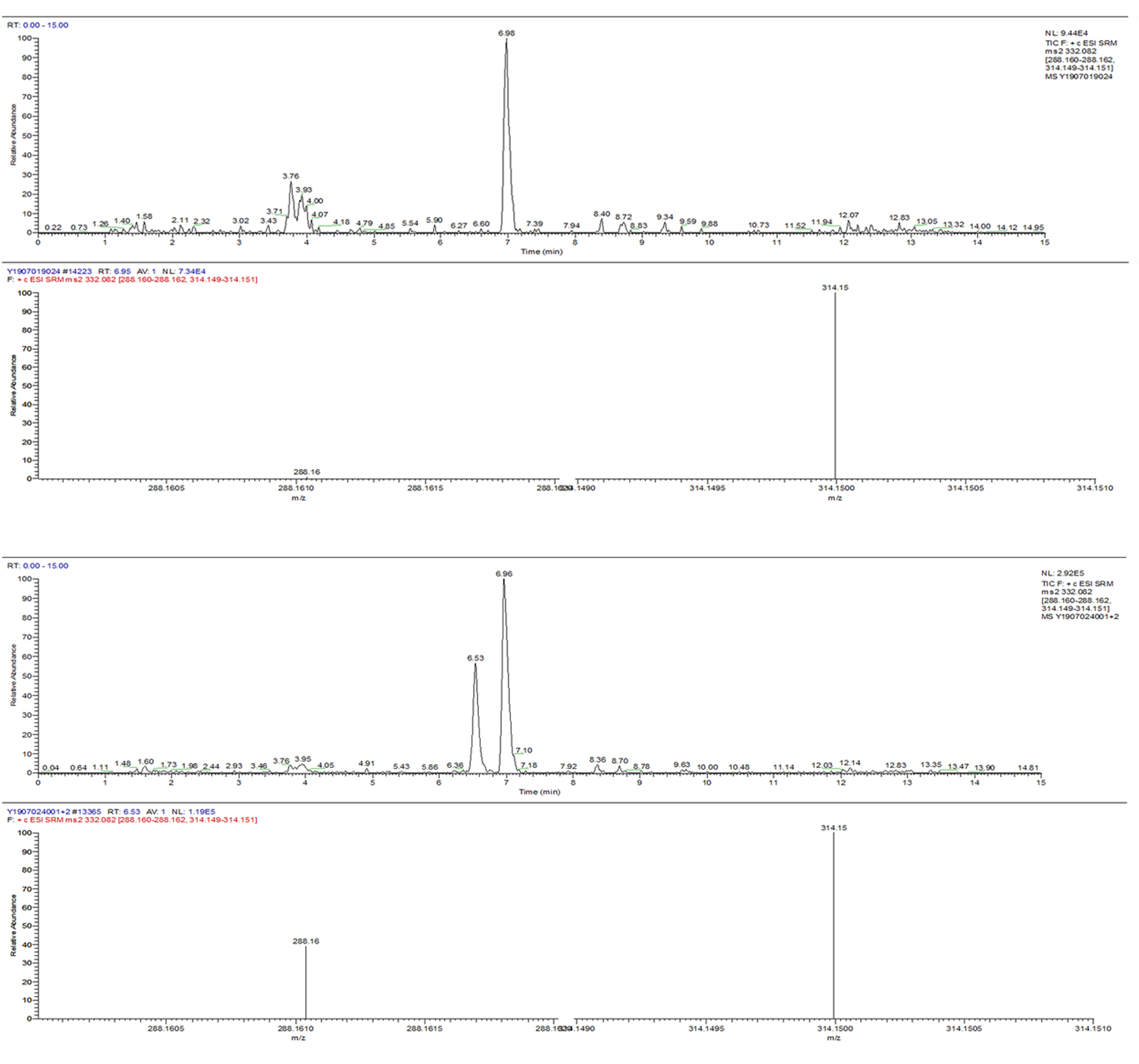
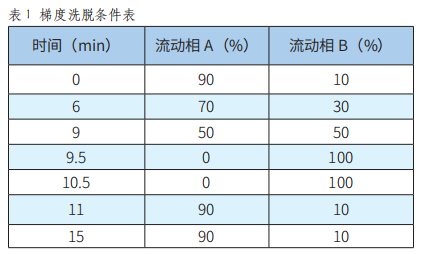
图1 羊肉中环丙沙星干扰峰的分离情况
2.1.2 色谱质谱条件
考察了有机相为100%乙腈、100%甲醇、40%甲醇+60%乙腈的出峰分离情况。结果显示,40%甲醇+60%乙腈在不同基质下分离度最好,目标化合物的保留时间在各种类型的基质中相对稳定,同时可将羊肉中的环丙沙星干扰物彻底分离。
考察了水相为纯水、0.2%甲酸水和5mmol甲酸铵水溶液的出峰分离情况,在水相中添加甲酸可提高仪器对目标化合物的响应且能够改善峰形,而甲酸铵会导致背景升高,影响方法灵敏度,故选择0.2%甲酸水。
将配制好的19种氟喹诺酮类化合物的混合标准中间溶液(1μg/mL)通过蠕动泵以5μL/min的流速注入质谱仪,调整离子源参数,待喷雾稳定后进行Q1四极杆全扫描,找到目标化合物的前体离子,设定碰撞能5~50eV区间分9次进行碰撞,通过Q3四极杆找到仪器响应和稳定性俱佳的定性离子和定量离子,同时进一步优化锥孔电压,从而建立多反应监测模式分析方法。19种化合物质谱参数优化结果见表2。
2.2 方法参数验证
2.2.1 线性实验
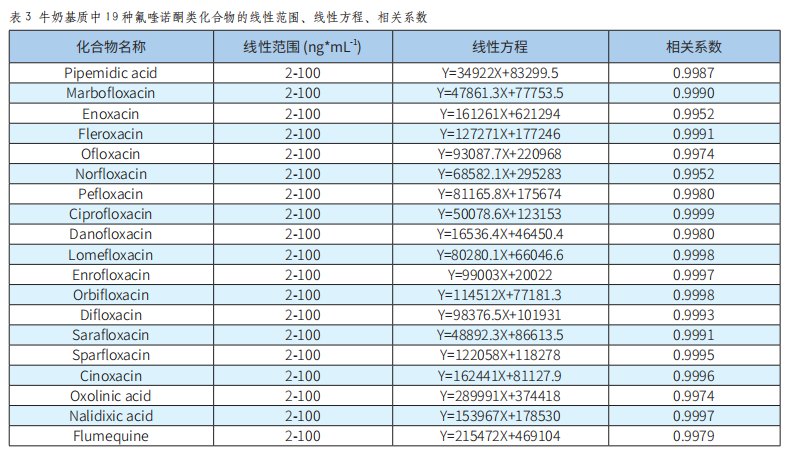
以牛奶为例,用空白基质提取液将混合标准工作溶液分别稀释浓度至2、5、10、20、100ng/mL,以氟喹诺酮质量浓度作为横坐标(X),定量离子的峰面积作为纵坐标(Y),进行线性拟合,得到基质匹配的标准曲线及相关系数,见表3。
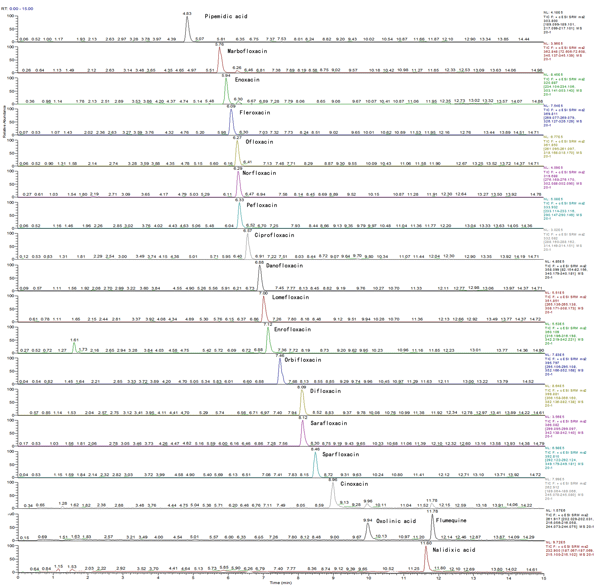
图2 20ng/mL牛奶基质中19种氟喹诺酮类化合物的总离子流图
2.2.2 方法的灵敏度
以取样量5.00g,在上述样品处理与色谱质谱条件下,根据3倍信噪比和10倍信噪比所对应的各氟喹诺酮药物质量浓度为仪器的检出限和定量限。方法中19种氟喹诺酮的检出限为0.03~0.5μg/kg,定量限为0.1~2μg/kg。
2.2.3 方法的精密度和回收试验
在牛奶、猪肉、鸡蛋阴性样品中分别添加0.1、20和100μg/kg这3个水平进行添加回收实验。按照上述方法进行测定,每个添加浓度测定6次,在较低浓度下,样品添加回收率在60%~120%,相对标准偏差<20%,方法精密度良好。
2.3 样品测定
采用上述检测方法,对市售猪肉、羊肉、牛奶等70份样品中19种氟喹诺酮类药物残留进行检测,检出氧氟沙星阳性样品1份,样品为羊肉,含量为15.8μg/kg。
3 结论与讨论
本实验运用超高效液相色谱-串联三重四极质谱联用仪建立的多反应监测模式下同时测定动物源性食品中19种氟喹诺酮类药物残留量,其灵敏度与回收率高,重现性好,抗干扰能力强,符合我国对喹诺酮类药物残留的监管要求,能够为食品安全风险监测工作提供准确有效的理论依据。
参考文献:
[1] Vakh C,Alaboad M,Lebedinets S,et al.An automated magnetic dispersive micro-solid phase extraction in a fluidized reactor for the determination of fluoroquinolones in baby food samples[J].Anal Chim Acta,2018,1001:59-69.
[2] 陈杖榴,兽医药理学[M].北京:中国农业出版社,2002,227-231.
[3] Gaskin HR,Collier CC.Anderson DB.Antibiotics as growth promotions:mode of action [J].Anim Biotechnol,2002,13:29-42.
[4] 陈杖榴,杨桂香,孙永学.兽药残留的毒性与生态毒理研究进展[J].华南农业大学学报,2001,22(1):88-91.
[5] 王勇,龚勇,卢明华.氟喹诺酮类药物残留检测方法的研究进展[J].中国畜牧兽医,2017,44(8):2509-2516.
[6] 张家禾,孟婷,周作红,等.动物性食品中氟喹诺酮类药物残留检测方法的研究进展[J].中国畜牧兽医.2014,41(5):262-266.
[7] Batt AL,Bruce IB.Evaluating the vulnerability of surface waters to antibiotic contamination from varying wastewater treatment plant discharges[J].Environ.Pollut,2006,142(2):295-302.
[8] Sergio M,Rossella G,Review:The evironmental release and face of antibiotics [J].Marine Pollution Bulletin,2014,79:7-15.
[9] Richard J.Fussell,Danny C.An assessment of atmospheric-pressure solids-analysis probes for the detection of chemicals in food[J].Trends in Analytical Chemistry,2010,29(11):1326-1335.
[10] Blasco C,Torres C M,Pico Y.Progress in analysis of residual antibacterials in food [J].
[11] 郭亚文,卜晓娜,刘楚君,王雅娟,等.动物源性食品中氟喹诺酮类药物残留色谱质谱检测技术研究[J].中国兽药杂志2019,53(1):1002-1280.
[12] 杨萍,刘阳,徐丹先等. 2016年云南省部分地区鸡蛋中兽药及禁用药物残留 监测结果分析[J].食品安全质量检测学报,2017,8(10):3854-3857.
[13] Gara-Galan MJ,Dlaz-Cruz S M,Kotarski S,et al.Identification and determination of metabolites and degradation products of sulfonamide antibiotics[J].Trends Anal.Chem,2008,27(11).
[14] Kennedyk KA, Rockwell S,Stark CA,et al.Preferential activation of mitomycin C to cytotoxic metabolites by hypoxic tumor cells[J].Cancer Res.,1980,40(7):2356-2360.
热点推荐
-

全十红红稗饼干|中秋团圆,回家必备
-

和汪氏蜂蜜共同来普及蜂蜜结晶现象
-

拿坡海开启西餐加盟新潮流, 大众化家庭小西餐成未来新趋势
-

摩购空间“霸王餐”来袭 打破传统营销套路带动商家业绩翻倍
-

开学季食安隐患猛增 禧云食安开展公益行动助力意识提升
-

基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性
-

安捷伦携手华大智造,共同推动实验室信息化系统与测序平台深度结
-
全自动在线免疫亲和固相萃取-液相色谱法快速定量检测植物油中的
-
基于酵母测试片促生长因子的研究
-
致病菌检验和鉴定技术在食品安全保障中的应用
-

多方共建高效检测体系,让真菌毒素无处遁形
-

安捷伦在BCEIA2019上展示创新产品和服务
-

非洲猪瘟的快速检测——速芯科技
-
气相色谱-质谱法测定食品中3-乙酰基-2,5-二甲基噻吩的含量
-

副溶血性弧菌的特征、分布及其致病风险评估研究概述
-
食品中的致病微生物沙门氏菌的商业化检测技术
-

领创前行、质能谱动,赛默飞于ASMS 2019发布高分辨质谱新品
-

常见真菌毒素的解读及其检测方案
-

MALDI-TOF MS在食品微生物中的应用:数分钟内确认和鉴定微生物
-

液相色谱串联质谱法检测鸡蛋中磺胺类药物
-

专业做产品、专注做服务,美正集团为食品安全行业贡献力量
-
岛津LabSolutions:实现网络时代创新性分析操作环境下的信息安全与
-

同方威视应用拉曼光谱技术,为食品快检行业赋能
-

聚焦安捷伦高端对话,探索食品检测创新技术
-

打造受业界尊敬且具有崇高公信力的第三方检测机构——SAG中检联
-

赛默飞SEMICON新品首发,助力我国半导体事业发展
-

胶体金免疫层析技术快速检测谷物中的黄曲霉毒素、玉米赤霉烯酮、
-

食品快速检测行业质量现状及情况分析
-

团结友爱、怀抱希望,踏上新征程
-

超临界二氧化碳层析分离番茄红素和番茄籽油





