金黄色葡萄球菌检验技术介绍及分析
2020-06-10 15:59:15 来源: 食品安全导刊
□ 李留洋 锐德检测技术(天津)有限公司
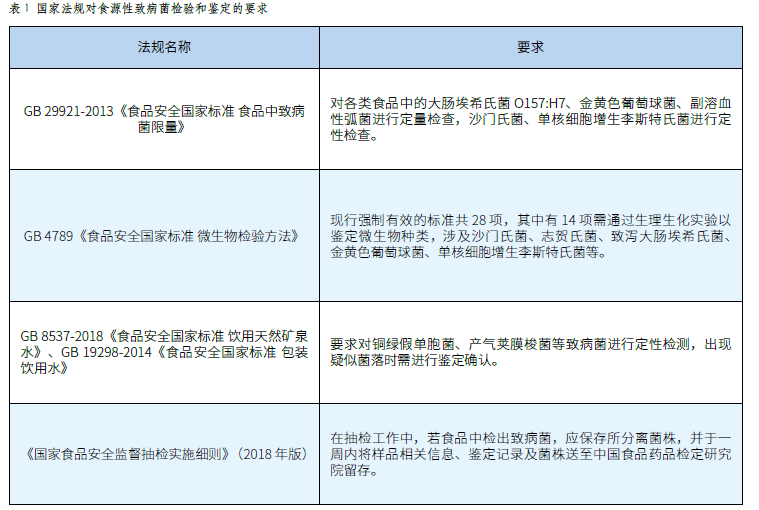
金黄色葡萄球菌是生活中最常见的病原菌之一,也是革兰氏阳性菌的代表,可引起许多严重的感染。该菌对营养的要求不高,在普通培养基上生长良好,需氧或兼性厌氧。容易受金黄色葡萄球菌污染的食品主要为乳制品、蛋及蛋制品、各类熟肉制品,其次是含有乳类的冷冻食品等,因此对于该菌的检验也被确定为食品致病性菌种检验中的重要项目。

图 1 样品处理
按照现行的国标方法,金黄色葡萄球菌检测方法分为第一法定性检验、第二法平板计数法(适用于金黄色葡萄球菌含量较高的食品),以及第三法MPN计数法(适用于金黄色葡萄球菌含量较低的食品)。
第一法定性检验过程包括样品处理、样品增菌、平板分离划线、初步鉴定、确证鉴定这5个步骤,整个流程全部完成至少需要5天时间。第二法平板计数法包括5个步骤——样品稀释、样品接种涂布、典型菌和可疑菌计数、鉴定试验、结果计算,整个流程全部完成至少需要4天时间。第三法MPN计数法同样包括5个步骤,即样品稀释、样品增菌、平板分离划线、鉴定试验、查MPN表确认结果,整个流程全部完成至少需要5天时间。以下将对金黄色葡萄球菌的检测流程进行简单介绍,并对难点、注意事项进行梳理和讲解。
1 第一法:金黄色葡萄球菌定性
1.1 样品处理
固态和半固态样品:称取25g样品至盛有225mL7.5%氯化钠肉汤中,充分混匀。
液体样品:吸取25mL样品至盛有225mL7.5%氯化钠肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
1.2 样品增菌
将上述样品匀液置于36±1℃的恒温培养箱中培养18~24h。
1.3 平板分离划线
该步骤是整个金黄色葡萄球菌检测环节中最重要的步骤之一,因为平板划线分离的效果决定了可疑菌落的判定和选择。平板划线选择三分法或四分法则分离效果较好,更容易出现单菌落平板。

图 2 血平板(左)与 BP 平板(右)
1.4 初步鉴定
分离的培养基选用Baird-Parker平板(BP平板)和血平板。结果显示,金黄色葡萄球菌在Baird-Parker平板上呈圆形,表面光滑、凸起、湿润,菌落直径为2~3mm,颜色呈灰黑色至黑色、有光泽,常有浅色(非白色)边缘,周围绕以不透明圈(沉淀),其外常有一清晰带,当用接种针触及菌落时具有黄油样黏稠感;有时可见到不分解脂肪的菌株——除没有不透明圈和清晰带外,其他外观基本相同;从长期贮存的冷冻或脱水食品中分离的菌落,其颜色常较典型菌落略浅,且外观可能较为粗糙,质地较干燥。在血平板上,金黄色葡萄球菌形成的菌落较大,呈圆形、光滑凸起、湿润、金黄色(有时为白色),菌落周围可见完全透明的溶血圈。结合两种培养基的特性即可确定可疑菌落。
1.5 确证鉴定
1.5.1 染色镜检
金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞和荚膜,直径约为0.5~1μm。
1.5.2 血浆凝固酶试验
挑取Baird-Parker平板或血平板上至少5个可疑菌落(小于5个则全选),分别接种到5mL BHI和营养琼脂小斜面,在36±1℃条件下培养18~24h。
购买冻干兔血浆,按照说明书加入0.5mL无菌生理盐水溶解,然后加入0.3mL BHI培养物,轻微摇晃至完全溶解或按照说明书直接将0.8mL BHI培养物加入到冻干兔血浆中轻微摇晃至完全溶解(一般选用后者),置于恒温培养箱中,每半小时观察一次凝集情况,连续观察6h。根据经验,若金黄色葡萄球菌呈强阳性,一般1~2h就可凝集,有的甚至长达3h才会凝集。需注意,切忌直接放置6h才进行观察,因为菌种凝固后会发生自溶现象,隔夜自溶是常见的判断。凝集的最好方法就是倒立观察结块,如倒立后内容物不下落,则效果较好。
1.5.3营养琼脂纯化
典型金黄色葡萄球菌在营养琼脂上一般呈黄色,较容易判断;有些呈淡色、白色,但不常见。如果认为鉴定结果可疑,可挑取营养琼脂小斜面的菌落到5mL BHI,36±1℃培养18~48h,重复试验。
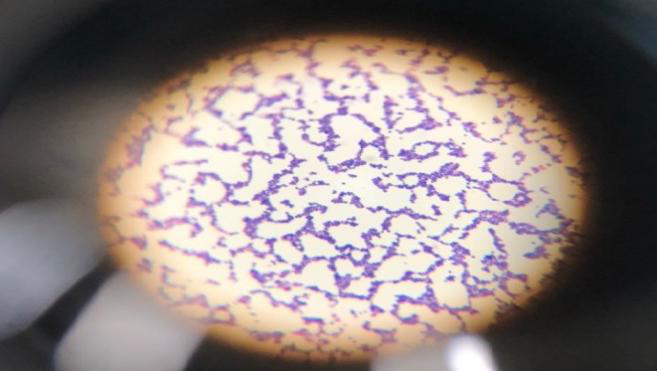
图 3 镜检
2 第二法:平板计数法
2.1 样品稀释
固态和半固态样品:称取25g样品至225mL稀释液中(可选用0.85%的生理盐水或磷酸盐缓冲溶液)充分混匀,即为稀释度10-1溶液,之后进行梯度稀释。
液体样品:吸取25mL样品至盛有225mL7.5%氯化钠肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃珠)中,振荡混匀。
2.2 样品接种涂布
选择性平板采用BP平板,该平板可提前一天配制——洁净台中放置过夜或置于25~50℃培养基中干燥,直到平板表面的水珠消失后备用。该步骤的目的是检查平板是否染菌,最重要的是挥发培养基内部的水分以利于涂布。每个梯度分别吸取1mL样品匀液,以0.3mL、0.3mL、0.4mL接种量分别接种至3块BP平板上,然后用无菌涂布棒涂布整个平板。如涂布棒不是一次性的,可以提前灭菌备用,也可用酒精灯灼烧2min以上冷却备用。涂布时尽量涂干,注意不要触及平板边缘。此后将平板静置10min,如样液不易吸收,可将平板放在培养箱36±1℃培养1h。等样品匀液吸收后翻转平板,倒置后于36±1℃培养24~48h(倒置培养的目的在于防止与空气中的细菌交叉污染,还可防止培养基水分挥发太快),观察结果。

图 4 典型菌落、阴性及阳性对照凝集效果
2.3 典型菌和可疑菌计数
从图5可以看出,10-1稀释度下菌落生长繁多,难以计数;最适计数范围为20~200CFU,故10-2稀释度满足计数要求,可疑菌总数在适宜计数范围内;而10-3稀释度下可疑菌落很少,故舍去。从10-2梯度上可以看出,具有沉淀环的菌落很多,这就需要从这些菌种中选择5个或以上可疑菌落进行血浆凝固酶试验,但是这5个菌落该如何选择才能使最终的结果最接近真实值是需要技巧的。
首先可以观察到,平板上的可疑菌落沉淀环有两种:一种是和菌落有些距离的沉淀环,记为可疑菌1——经过后期确认试验可知此菌为干扰菌,即表皮葡萄球菌;另一种是从菌落边缘直接延伸出来的沉淀环,记为可疑菌2。将所有可疑菌1与所有可疑菌2的菌落数出来,可判断出可疑菌落是两类不同的细菌。根据两者的比例,决定挑选可疑菌落数的分配情况,比例大的多选,比例小的少选。

图 5 不同稀释度条件下的菌落生长状态
2.4 鉴定试验
平板法的鉴定试验过程及注意事项按第一法的“1.4”“1.5”进行。
2.5 结果计算
①若只有一个稀释度平板的典型菌落数在20~200CFU之间,应计数该稀释度平板上的典型菌落,按式(1)计算;
②若最低稀释度平板的典型菌落数小于20CFU,应计数该稀释度平板上的典型菌落,按式(1)计算;
③若某一稀释度平板的典型菌落数大于200CFU,但下一稀释度平板上没有典型菌落,应计数该稀释度平板上的典型菌落,按式(1)计算;
④若某一稀释度平板的典型菌落数大于200CFU,而下一稀释度平板上虽有典型菌落但不在20~200CFU范围内,应计数该稀释度平板上的典型菌落,按式(1)计算;
⑤若2个连续稀释度的平板典型菌落数均在20~200CFU之间,应按式(2)计算。
式(1):
式(1)中,T为样品中金黄色葡萄球菌菌落数;A为某一稀释度典型菌落的总数;B为某一稀释度鉴定为阳性的菌落数;C为某一稀释度用于鉴定试验的菌落数;d为稀释因子。
式(2):
式(2)中,T为样品中金黄色葡萄球菌菌落数;A1为第一稀释度(低稀释倍数)典型菌落的总数;B1为第一稀释度(低稀释倍数)鉴定为阳性的菌落数;C1为第一稀释度(低稀释倍数)用于鉴定试验的菌落数;A2为第二稀释度(高稀释倍数)典型菌落的总数;B2为第二稀释度(高稀释倍数)鉴定为阳性的菌落数;C2为第二稀释度(高稀释倍数)用于鉴定试验的菌落数;1.1为计算系数;d为稀释因子(第一稀释度)。
3 第三法:MPN计数法
3.1 样品稀释
按照“2.1”进行。
3.2 样品增菌
根据对样品污染状况的估计,选择3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释的同时,每个稀释度分别接种1mL样品匀液至7.5%氯化钠肉汤管(如接种量超过1mL,则用双料7.5%氯化钠肉汤)。每个稀释度接种3管,将上述接种物于36℃±1℃培养18~24h。用接种环从培养后的7.5%氯化钠肉汤管中分别取培养物1环,移种于Baird-Parker平板,36±1℃下培养24~48h。
3.3 平板分离划线
用接种环从培养后的7.5%氯化钠肉汤管中分别取培养物1环,移种于Baird-Parker平板,36±1℃下培养24~48h。
3.4 鉴定试验
MPN法的鉴定试验过程及注意事项按第一法的“1.4”“1.5”进行。
3.5 查MPN表确认结果
MPN结果按GB 4789.10-2016中附录C查询。
4 总结
以上便是金黄色葡萄球菌检样3种方法的简单操作过程。该菌检测过程的关键步骤是划线分离和可疑菌落的判定,其中不要放过任何一个可疑菌落;检测人员进行血浆凝固酶试验时,需要注意对时间和凝固现象的把控,有些细节的处理还需要大量经验的积累。
热点推荐
-

全十红红稗饼干|中秋团圆,回家必备
-

和汪氏蜂蜜共同来普及蜂蜜结晶现象
-

拿坡海开启西餐加盟新潮流, 大众化家庭小西餐成未来新趋势
-

摩购空间“霸王餐”来袭 打破传统营销套路带动商家业绩翻倍
-

开学季食安隐患猛增 禧云食安开展公益行动助力意识提升
-

金黄色葡萄球菌检验技术介绍及分析
-
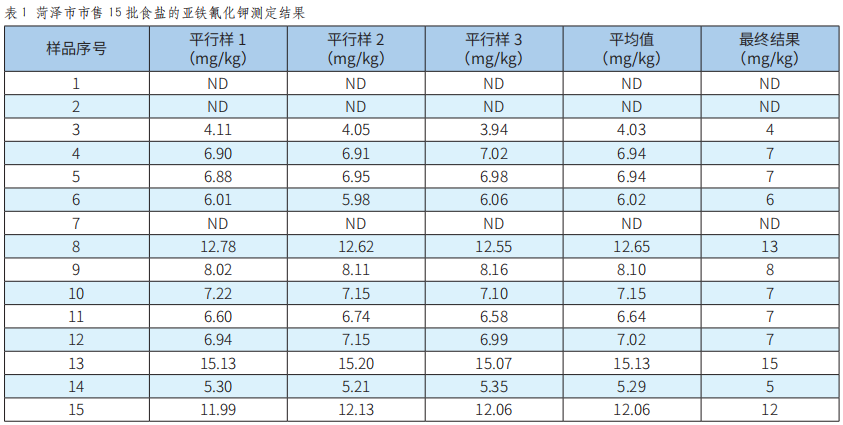
市售食盐中亚铁氰化钾含量的测定
-

包装饮用水中微生物快速检测的必要性分析
-

MALDI Biotyper®提高了中国工业微生物菌种保藏中心微生物鉴定
-
基于多反应监测模式下的超高效液相色谱-串联质谱法检测动物源性
-

安捷伦携手华大智造,共同推动实验室信息化系统与测序平台深度结
-
全自动在线免疫亲和固相萃取-液相色谱法快速定量检测植物油中的
-
基于酵母测试片促生长因子的研究
-
致病菌检验和鉴定技术在食品安全保障中的应用
-

多方共建高效检测体系,让真菌毒素无处遁形
-

安捷伦在BCEIA2019上展示创新产品和服务
-

非洲猪瘟的快速检测——速芯科技
-
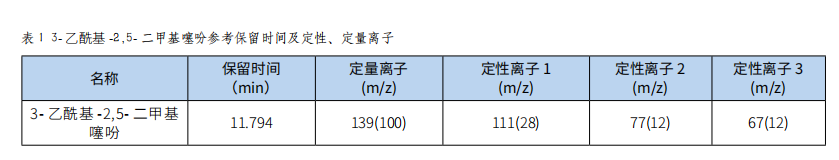
气相色谱-质谱法测定食品中3-乙酰基-2,5-二甲基噻吩的含量
-

副溶血性弧菌的特征、分布及其致病风险评估研究概述
-
食品中的致病微生物沙门氏菌的商业化检测技术
-

领创前行、质能谱动,赛默飞于ASMS 2019发布高分辨质谱新品
-

常见真菌毒素的解读及其检测方案
-

MALDI-TOF MS在食品微生物中的应用:数分钟内确认和鉴定微生物
-

液相色谱串联质谱法检测鸡蛋中磺胺类药物
-

专业做产品、专注做服务,美正集团为食品安全行业贡献力量
-
岛津LabSolutions:实现网络时代创新性分析操作环境下的信息安全与
-

同方威视应用拉曼光谱技术,为食品快检行业赋能
-

聚焦安捷伦高端对话,探索食品检测创新技术
-

打造受业界尊敬且具有崇高公信力的第三方检测机构——SAG中检联
-

赛默飞SEMICON新品首发,助力我国半导体事业发展





