食品危害物适配体截短优化及其应用研究进展
2021-11-30 15:15:33 来源: 食品安全导刊
食品危害物适配体截短优化及其应用研究进展
梁 好,徐学明*
(江南大学食品学院,江苏无锡 214000)
作者简介:梁好(2000—),女,山西朔州人,本科在读。研究方向:食品科学与工程。
通信作者:徐学明(1968—),男,江苏苏州人,博士,教授。研究方向:谷物食品。E-mail:xmxu@jiangnan.edu.cn。
摘 要:食源性疾病作为全球性公共卫生问题之一,具有分布面广、死亡率高的特点,对人类健康构成了严重威胁。相较于实验成本高、处理复杂且难以运用于现场检测的传统检测方法,核酸适配体作为一种新型识别分子,已被广泛应用于多种食品危害物的检测。此外,经过序列优化的核酸适配体在原有的功能上具有更高的亲和力与更优越的识别性能,目前正逐渐成为研究趋势之一。本文主要对近年来食品危害物核酸适配体序列优化的方法及经过截短优化后适配体传感器的研究进展进行综述。
关键词:食品危害物;检测;核酸适配体;截短优化;生物传感器
食源性疾病是当前食品安全面临的重大问题,已成为全球性公共卫生问题之一。据有关数据统计,全世界范围内每年有数十亿人患有食源性疾病,其中,我国每年发生食源性疾病人数近千万人次[1]。因此,对食品危害物进行快速、灵敏检测,对降低食源性疾病发生率、提高国民身体健康度及维护国家社会稳定性具有非常重要的作用。
目前,常见的食品危害物检测方法主要有仪器分析法、免疫分析法、平板分离法等。其中,仪器分析法包括气相色谱法、高效液相色谱法等,这类方法具有精密度高、重复性好的优点,但所用仪器昂贵、样品前处理复杂;免疫分析法包括酶联免疫吸附法、荧光免疫测定法等,但由于抗体制备成本高、重复性差,现场检测的运用受到限制;平板分离法主要用于致病菌的检测,结果稳定性较好,但检测周期较长,一般需要3~5 d[2]。
20世纪90年代发现的核酸适配体分子探针给食品危害物的检测带来了新的机遇。核酸适配体(Aptamer)又称“化学抗体”,是一种能折叠成特定三维结构并特异性结合靶标分子的单链DNA或RNA,一般长度在20~100个碱基之间[3]。它可以通过指数富集的配体系统进化技术(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)从体外筛选获得,目前很多致病菌、真菌毒素、重金属离子等食品危害物的核酸适配体均已有报道。此外,目前很多体外筛选获得的核酸适配体序列初始长度为80 bp左右[4],随着人们对核酸适配体研究的深入,越来越多的研究表明,对核酸适配体序列进行截短、裂分优化后,其仍然保有原有的功能性质,甚至识别性能更优越[5]。与此同时,通过序列优化还可以进一步揭示核酸适配体序列结构与功能之间的关系,有利于理解核酸适配体-靶标作用机制。因此,核酸适配体的序列优化及作用机制等方面的研究已逐渐成为研究热点。本文主要总结了近年来已报道的食品危害物核酸适配体的序列优化及其应用情况,以期为今后食品危害物核酸适配体生物传感器的开发和应用提供借鉴。
1 食品危害物核酸适配体序列优化现状
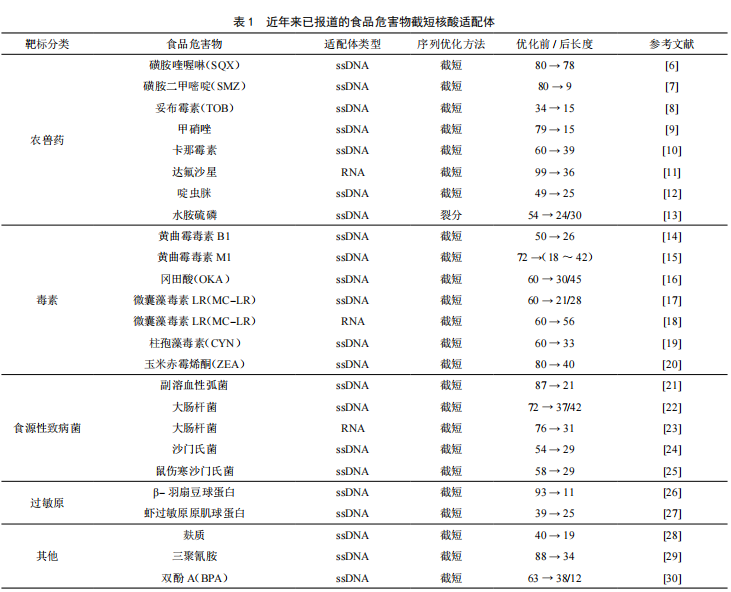
截至目前,已报道的食品危害物核酸适配体大约有80种,主要包括抗生素、致病菌、农兽药残留、生物毒素等,其中约有23种已被报道进行序列优化,占比28.8%,具体如表1所示。由此可见,对核酸适配体序列进行优化正逐渐受到广大研究人员的关注。从表1还可以看出,目前优化效果显著的食品危害物核酸适配体序列之一为β-羽扇豆球蛋白,优化后其长度缩短为11 bp,为最初适配体序列长度的12%,其亲和力提高了约211倍,检测灵敏度达150 pM,相较基于抗体的ELISA技术具有明显的提升。因此,对核酸适配体序列进行优化不仅可以降低序列合成成本,还有利于改善其生物传感器的性能。
2 食品危害物核酸适配体序列优化方法
对核酸适配体序列优化的目的主要包括两个方面:①缩短序列长度,降低合成成本;②提升核酸适配体稳定性,增强其应用能力。基于以上目的,当前对核酸适配体序列进行优化的方法主要包括截短优化、裂分优化及突变优化等。
2.1 截短优化
经过SELEX技术从核酸文库中筛选的能特异性结合靶标的核酸适配体全长一般在80 bp左右。近年来有很多研究表明,筛选得到的序列并不是全部参与靶标的结合,真正与靶标特异性结合的核苷酸通常不大于15个[31-32]。ZHOU等[33]研究发现,在某些条件下,当核酸适配体与靶标分子结合时,非必需核苷酸的存在将干扰这一过程的进行。ZHENG和GAO[34-35]等人研究表明,较短的核酸适配体序列具有更好的结合亲和力与靶标特异性。CHINNAPPAN等人[16]将冈田酸(Okadaic Acid,OKA)适配体截短为两个序列,一个标记为6-羧基荧光素(FAM),另一个标记有淬灭基团,构建了OKA的荧光检测方法。经过研究发现,相较于全长适配体序列(Kd=526 nmol/L),截短后的核酸适配体具有更卓越的结合能力(Kd=2.77 nmol/L)。以上研究结果表明,采用截短优化的方法有利于提高核酸适配体的识别与结合能力,降低序列合成成本,从而有利于开发更经济实惠的生物传感器。

2.2 裂分优化
2000年,STOJANOVIC等[36]首次报道将可卡因核酸适配体裂分成长度分别为16 bp和27 bp的两条链,并成功构建了三明治夹心型核酸适配体荧光生物传感器,实现了可卡因的检测。至此,裂分核酸适配体逐渐受到人们关注。水胺硫磷(ICP)作为一种广谱性杀虫、杀螨剂,因其高毒性作用被禁止用于蔬菜、部分果树及中草药等作物。LI等人[13]将长度为54 bp的水胺硫磷(ICP)核酸适配体裂分成24 bp和30 bp两个片段,结合多壁碳纳米管(MWCNT)和G四链体构建了一种无酶、免标记的荧光检测方法,该方法具有较强的选择性和灵敏性,在最佳条件下检测限达10 nmol/L。根据目前的报道,裂分型核酸适配体数量不多,在食品安全领域的应用远少于截短优化,其中针对食品危害物核酸适配体本身的裂分方法更加有限。除了起步晚之外,其主要原因可能是适配体和靶标的结合机制尚未明晰,从而导致裂分成功率不高。
2.3 突变优化
突变优化主要是对核酸适配体上的单个或多个碱基进行化学修饰或碱基突变,以提高其稳定性和结合性能。这种优化方式常有助于理解并揭示核酸适配体与靶标分子的结合机制。SUN等人[21]对副溶血弧菌核酸适配体进行截短优化后,发现CAGTGA组成的6碱基环状结构可能是靶标结合的关键区域,因此作者采用定点突变的方式对这部分序列进行优化,当这部分序列被其他碱基取代后,适配体序列亲和力大大降低,由此证明了这一结构对危害物识别过程的重要性。
3 食品危害物截短核酸适配体生物传感器应用
生物传感器是将专一性的生物感应件元件与能够产生和待测物浓度成比例的信号传导器相结合的一种能实现对待测物进行定性或定量分析的装置[37]。相对于其他类型生物传感器,核酸适配体生物传感器作为一种新兴技术,具有更好的选择性、灵敏度和稳定性,在食品安全检测领域的研究报道越来越多。根据其传导信号的不同,可将其分为荧光适配体传感器、比色适配体传感器和电化学适配体传感器等。
3.1 荧光适配体传感器
荧光适配体传感器是根据核酸适配体与待测物质特异性结合产生的荧光信号而建立的一类传感器。由于荧光的变化强度常常与待测物浓度成正比关系,因此可以对靶标进行定量测定。CHINNAPPAN等人[27]认为筛选获得的核酸适配体序列其引物结合区可能不参与适配体/靶标复合物的形成,基于此,他们将虾过敏原——原肌球蛋白(TM)适配体序列的两端引物结合区序列截短去除,基于Mfold软件预测的二级结构设计了两条长度分别为14 bp和25 bp的序列。然后将此两条截短序列和母序列分别作为分子探针构建了一种基于氧化石墨烯(GO)纳米材料的荧光适配体传感器。由于适配体与氧化石墨烯的共轭作用,荧光标记的核酸适配体被吸附在GO上时,荧光被猝灭,在没有TM时,体系的荧光强度保持不变,当TM出现时,TM和核酸适配体特异性结合,将其从GO表面解离下来,荧光得到恢复,从而可以实现TM的检测。研究结果表明,截短后获得的长度为25 bp的序列其亲和力比母核酸适配体提高了4倍,检测限(LOD)可达2 nmol/L。该传感器在使用TM加标的样品中展现出良好的性能并实现了97%±10%的回收率,此外还具有选择性好、检测快速等优点,在30 min内即可完成检测。
3.2 比色适配体传感器
和荧光适配体传感器相比,比色适配体传感器具有实验结果肉眼可见的特点,无需复杂设备即可完成对待测危害物的检测。金纳米颗粒(Au NPs)是最常用的比色法检测的纳米材料,由于其易于合成、修饰,已被广泛用作比色适配体传感器。TIAN等人[12]基于纳米金构建了农药残留物啶虫脒的比色适配体传感器。他们从49 bp的核酸适配体序列中删去多余的侧翼核苷酸,获得了43 bp、40 bp、37 bp和25 bp 4条序列。研究发现截短后的25 bp长的截短序列对啶虫脒具有更好的亲和力,随后他们以此为基础构建了基于纳米金的截短核酸适配体生物传感器检测方法,其灵敏度是母序列的3.5倍。
3.3 电化学适配体传感器
电化学适配体传感器是指将识别元件与靶标物质的特异性结合转化为电流信号的一类传感器。常见的电化学分析技术有差分脉冲伏安法(DPV)、电化学阻抗法(EIS)、方波伏安法(SWV)、循环伏安法(CV)等,其中已报道的应用于食品危害物检测方面的方法较为有限。SVIGELJ等[28]将相应的核酸适配体序列从40 bp截短优化至长度仅为19 bp的短序列,并以此序列开发了一种夹心式的电化学传感器,用于谷蛋白的检测。研究结果表明,与原始母核酸适配体分子探针相比,这种以截短核酸适配体构建的三明治式传感器的检测更加灵敏。
4 结语
由食品危害物导致的食源性疾病正严重危害着人们的身体健康,因此建立方便、快捷及灵敏的食品危害物检测方法尤为重要。经过序列优化后的适配体具有良好的亲和力、识别特性及选择性,能够在降低实验成本的同时极大地提高检测灵敏度,已被广泛用于构建荧光、比色、电化学等适配体传感器。但核酸适配体的序列优化仍有提升的空间,需要将核酸适配体构效关系、作用机制等与序列优化结合起来以提升优化效果。同时,在核酸适配体生物传感器方面,非标记型生物传感器逐渐受到青睐,可能是今后重点发展的研究方向之一。相信在广大科研工作者的不懈努力下,核酸适配体序列的优化效率将会更高、技术更成熟,在食品安全检测方面必将得到长足的应用。
参考文献
[1]金少华,徐粒子.食源性疾病(致病菌)监测与调查处置研究进展[J].安徽预防医学杂志,2010,16(6):458-461.
[2]周游,王周平.食品危害物及其检测方法研究进展[J].生物加工过程,2018,16(2):24-30.
[3]CAI S,YAN J,XIONG H,et al.Investigations on the interface of nucleic acid aptamers and binding targets[J].Analyst,2018,143(22):5317-5338.
[4]KU T H,ZHANG T,LUO H,et al.Nucleic acid aptamers: an emerging tool for biotechnology and biomedical sensing[J].Sensors,2015,15(7):16281-16313.
[5]孙玉琼,袁宝银,邓美桃,等.核酸适配体序列优化策略的研究进展[J].化学传感器,2018,38(2):12-22.
[6]SHI H,KOU Q,WU P,et al.Selection and application of dna aptamers against sulfaquinoxaline assisted by Graphene Oxide-Based SELEX[J].Food Analytical Methods,2020:1-10.
[7]KOU Q,WU P,SUN Q,et al.Selection and truncation of aptamers for ultrasensitive detection of sulfamethazine using a fluorescent biosensor based on graphene oxide[J].Analytical and Bioanalytical Chemistry,2021,413(3):901-909.
[8]NIE J,YUAN L,JIN K,et al.Electrochemical detection of tobramycin based on enzymes-assisted dual signal amplification by using a novel truncated aptamer with high affinity[J].Biosensors & Bioelectronics,2018,122:254-262.
[9]WEI H,CAI R F,YUE H,et al.Screening and application of a truncated aptamer for high-sensitive fluorescent detection of metronidazole[J].Analytica Chimica Acta,2020,1128:203-210.
[10]HA N R,JUNG I P,LA I J,et al.Ultra-sensitive detection of kanamycin for food safety using a reduced graphene oxide-based fluorescent aptasensor[J].Scientific Reports,2017,7(1):752-758.
[11]HAN S R,YU J,LEE S.In vitro selection of RNA aptamers that selectively bind danofloxacin[J].Biochemical and Biophysical Research Communications,2014,448(4):397-402.
[12]TIAN Y,WANG Y,SHENG Z,et al.A colorimetric detection method of pesticide acetamiprid by fine-tuning aptamer length[J].Analytical Biochemistry,2016,513:87-92.
[13]LI X,TANG X,CHEN X,et al.Label-free and enzyme-free fluorescent isocarbophos aptasensor based on MWCNTs and G-quadruplex[J].Talanta,2018,188:232-237.
[14]LINLIN S,QIANG Z.Direct fluorescence anisotropy approach for aflatoxin B1 detection and affinity binding study by using single tetramethylrhodamine labeled aptamer[J].Talanta,2018,189:442-450.
[15]PANDEY A K,RAJPUT Y S,SINGH D,et al.Prediction of shorter oligonucleotide sequences recognizing aflatoxin M1[J].Biotechnology and Applied Biochemistry,2018,65(3):397-406.
[16]CHINNAPPAN R,ALZABN R,MIR T A,et al.Fluorometric determination of okadaic acid using a truncated aptamer[J].Microchimica Acta,2019,186(7):406.
[17]RAJA C,RAZAN A,KHALID M,et al.An aptamer based fluorometric microcystin-LR assay using DNA strand-based competitive displacement[J].Microchimica Acta,2019,186(7):435.
[18]陈思锐,侯建军,刘细霞,等.基于核酸适配体的微囊藻毒素LR纳米金生物传感检测方法的建立及其识别机制研究[J].食品安全质量检测学报,2019,10(17):5748-5753.
[19]RAJA C,RAZAN A,AMJAD K F,et al.Probing high-affinity aptamer binding region and development of aptasensor platform for the detection of cylindrospermopsin[J].Analytical and Bioanalytical Chemistry,2020,412(19):4691-4701.
[20]AZRI F A,EISSA S,ZOUROB M,et al.Electrochemical determination of zearalenone using a label-free competitive aptasensor[J].Microchimica Acta,2020,187(5):266.
[21]SUN Y,DUAN N,MA P,et al.Colorimetric aptasensor based on truncated aptamer and trivalent dnazyme for vibrio parahemolyticus determination[J].Journal of Agricultural and Food Chemistry,2019,67(8):2313-2320.
[22]WU W,ZHANG J,ZHENG M,et al.An aptamer-based biosensor for colorimetric detection of escherichia coli O157:H7[J].Plos One,2012,7(11):e48999.
[23]DUA P,REN S,LEE S W,et al.Cell-SELEX based identification of an rna aptamer for escherichia coli and its use in various detection formats[J].Molecules and Cells,2016,39(11):807-813.
[24]CHINNAPPAN R,ALAMER S,EISSA S,et al.Fluorometric graphene oxide-based detection of Salmonella enteritis using a truncated DNA aptamer[J].Microchimica Acta,2018,185(1):61-69.
[25]丁忠英.鼠伤寒沙门菌比色检测的适配体生物传感器研究[D].温州:温州医科大学,2011.
[26]MAIRAL T,NADAL P,SVOBODOVA M,et al.FRET-based dimeric aptamer probe for selective and sensitive Lup an 1 allergen detection[J].Biosensors & Bioelectronics,2014,54:207-210.
[27]CHINNAPPAN R,RAHAMN A A,ALZABN R,et al.Aptameric biosensor for the sensitive detection of major shrimp allergen, tropomyosin[J].Food Chemistry,2020,314:1-7.
[28]SVIGELJ R,DOSSI N,PIZZOLATO S,et al.Truncated aptamers as selective receptors in a gluten sensor supporting direct measurement in a deep eutectic solvent[J].Biosensors & Bioelectronics,2020,165:112339.
[29]GU C,XIANG Y,GUO H,et al.Label-free fluorescence detection of melamine with a truncated aptamer[J].The Analyst,2016,141(14):4511-4517.
[30]JIA M,SHA J,LI Z,et al.High affinity truncated aptamers for ultra-sensitive colorimetric detection of bisphenol A with label-free aptasensor[J].Food Chemistry,2020,317(1):126459.
[31]GOLD L,POLISKY B,UHLENBECK O,et al.Diversity of oligonucleotide functions[J].Annual Review of Biochemistry,
1995,64(1):763-797.
[32]JAYASENA S D.Aptamers: An emerging class of molecules that rival antibodies in diagnostics[J].Clinical Chemistry,1999,45(9):1628-1650.
[33]ZHOU J,SOONTORNWORAJIT B,SNIPES M P,et al.Structural prediction and binding analysis of hybridized aptamers[J].Journal of Molecular Recognition,2011,24(1):119-126.
[34]ZHENG X,HU B,GAO S X,et al.A saxitoxin-binding aptamer with higher affinity and inhibitory activity optimized by rational site-directed mutagenesis and truncation[J].Toxicon,2015,101:41-47.
[35]GAO S,HU B,ZHENG X,et al.Gonyautoxin 1/4 aptamers with high-affinity and high-specificity:From efficient selection to aptasensor application[J].Biosensors & Bioelectronics,2016,79:938-944.
[36]STOJANOVIC M N,DE PRADA P,LANDRY D W.Fluorescent sensors based on aptamer self-assembly[J].Journal of the American Chemical Society,2000,122(46):11547-11548.
[37]李双,韩殿鹏,彭媛,等.食品安全快速检测技术研究进展[J].食品安全质量检测学报,2019,10(17):5575-5581.
热点推荐
-

使用梅特勒-托利多X光机的五大理由
-

小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金秋喜迎初丰收
-

全球食品创新平台第五期已启动,携手共创安全、健康、绿色的未来
-
特医食品不是药,却是临床治疗的关键支撑
-

“喂饱”体内的益生菌,肠道更健康
-

食品危害物适配体截短优化及其应用研究进展
-

食药用菌多糖抑菌作用研究进展
-
快速检测在某铁路局食品安全监管中的应用分析
-
“双高”建设项目引领的绿色食品专业群建设与实践
-

江西九岭山保护区毒蘑菇一新记录种——日本红菇
-

武夷岩茶感官品质的审评
-

豆渣吸附刚果红的性能
-
光谱和光谱成像技术在食品检测中的应用分析
-
紫苏风味鸡肉丸加工工艺的研究
-
β-葡萄糖苷酶固体发酵培养条件的优化
-

青梅调味酱生产工艺及其功效研究
-
衡阳市城区消费者食品营养标签认知及影响因素分析
-
学龄儿童视力保护食谱设计与编制
-
大学生对转基因食品的认知与态度探究——以石家庄市为例
-
厦门市现制和自制饮品卫生状况调查与分析
-
乳中地塞米松残留量检测方法的改进研究
-
植物酵素发酵过程中几种功效酶的动态变化及减肥功效评价
-
饮料中铅含量的测定能力验证样品的稳定性和均匀性分析
-
ELISA法检测油菜籽中的黄曲霉毒素B1
-
氰化物中毒犬只样品采样要点
-
高效液相色谱法同时测定果酱中6种合成着色剂
-
超高相液相色谱-串联质谱法测定鲜猪肉中8种磺胺类药物残留
-

基于漫反射红外光谱法的粮食真菌毒素检验方法
-

顶空-气相色谱法快速测定冰淇淋中环氧乙烷残留量
-
超高效液相色谱-串联质谱法测定动物源性食品中20种磺胺类药物残留





