氰化物中毒犬只样品采样要点
2021-11-29 16:20:05 来源: 食品安全导刊
氰化物中毒犬只样品采样要点
徐玲萍,程文聪,张芳芳
(台州市食品检验检测中心,浙江台州 318000)
摘 要:采取氰化物中毒犬只各个部位的样本,采用异烟酸比色法测定组织中氰化物的含量。通过检测发现,每一个部位的氰化物含量都不相同,胃中含量最高,其次是肝脏,肉组织中含量比较低。样本的存储温度和时间对检测值也有一定影响,冷冻冷藏保存的样品测定数值比较稳定,氰化物在20 d内降解较慢,常温保存样品测定值与新鲜样品测定值有明显差异。因此针对使用氰化物等非法毒物捕杀的犬只应采集胃部,样本应存储于冷藏冷冻环境中,并尽快送检,才能保证出具的数据最有效可靠。
关键词:狗肉;氰化物;采样部位;存储方式
一些地区有吃狗肉的习俗,随着越来越多的狗肉被消费,市场上也有一些非法的狗肉来源,如用毒物扑杀的犬只。氰化物是一种速杀型毒物,氢氰酸口服致死量为0.06 g,氰酸盐为0.1~0.3 g。氰化物进入人体内能迅速与细胞色素氧化酶中的3价铁结合,组织细胞无法利用血液中的氧而造成内窒息。中枢神经系统对缺氧尤为敏感,氰化物中毒的犬表现为不同程度的中枢性呼吸衰竭症状。犬只吸入高浓度的氰化氢气体或吞服大量氰化物,可在数s至5 min内停止呼吸,呈“电击样”死亡[1]。由于其快速高效,氰化物常常被用作扑杀犬只的主要毒物。氰化物在动物、人体内不易被分解,人食用被氰化物毒害的狗肉后,轻则出现头痛、头昏、恶心呕吐、食欲不振等中毒症状,严重的会因全身功能衰竭而死亡[2]。因而在对犬只的氰化物检验中应该执行最为严谨的检测规定。然而样本的有效性是所有检验工作的前提和基础。制定取样计划时,必须考虑检测的目的、样本的性质、检测方法的特点等。取样程序应该准确规范,选用适宜的取样工具,熟练掌握取样操作技术,有效防止交叉污染。样本的运输和保存应该考虑周全,避免检测目标物的损失或失效,做好正确的标识和记录[3]。
1 材料与方法
1.1 仪器与设备
分光光度计(UV2600岛津);电子天平(奥豪斯,SA223S-CW);移液枪(Eppendorf,1~5 mL),冰箱。
1.2 材料与试剂
(1)异烟酸-吡唑啉酮。称取1.5 g异烟酸溶于24 mL氢氧化钠(20 g/L)溶液中,加水定容至100 mL,另取0.25 g吡唑啉酮,溶于20 mL无水乙醇中,合并上述两种溶液,摇匀。
(2)氯胺T。称取1 g氯胺酮溶于水中,稀释至100 mL。
(3)磷酸盐缓冲溶液。称取34.0 g无水磷酸二氢钾和35.5 g无水磷酸氢二钠,溶于水并稀释至1 000 mL[4]。
乙酸、氢氧化钠、乙酸锌、酒石酸均为分析纯。
1.3 样品的制备
犬1、犬2、犬3、犬4、犬5和犬6共6条氰化物中毒犬只为本次实验对象。解剖犬只,取每一只犬的舌头、胃、犬大腿肌肉、肝脏等5个部位的组织,依次分别匀浆,共形成30个样品,马上测定其氰化物的含量,并留取中毒犬只胃及其内容物样品待用。
称取上述6条中毒犬只的胃及其内容物样品,每份5 g,分装至试管内,密封,保存到4 ℃冰箱内,共6份样品,于1 d、3 d、8 d、15 d、20 d和30 d后,分别测定其氰化物的含量。
称取上述6条中毒犬只的胃及其内容物样品,每只中毒犬取两份,每份5 g,依次装到试管内并密封,再依次保存到-20 ℃、25 ℃的坏境中,共形成12份样品,于20 d后分别测定其氰化物的含量。
1.4 试验方法
1.4.1 标准溶液的配制
吸取0 mL、0.3 mL、0.6 mL、0.9 mL、1.2 mL、1.5 mL和2.0 mL的1 mg/L氰标准溶液于25 mL比色管中,加水定容至10 mL。
1.4.2 样品前处理
称取样品5 g于500 mL蒸馏瓶中,加蒸馏水浸没样品,加100 g/L乙酸锌溶液20 mL,加入酒石酸2 g,迅速连接好蒸馏装置,加热蒸馏。将冷凝管下端插入10 g/L氢氧化钠10 mL中,收集蒸馏液并用纯水定容至50 mL,移取10 mL蒸馏液于25 mL比色管中。
试样溶液及标准溶液各加酚酞1滴,用乙酸(1+20)调至红消失,再用2 g/L氢氧化钠溶液调至近红色,然后加5 mL磷酸盐缓冲溶液,37 ℃水浴10 min,再加入0.25 mL氯胺T溶液,摇匀放置5 min,加入5 mL异烟酸-吡唑啉酮溶液,加水稀释至刻度,加塞振荡混合均匀,在37 ℃恒温水浴锅中放置40 min,取出用1 cm比色杯以零管调节零点,于波长638 nm处测吸光度[5-6]。
2 结果与分析
2.1 采样部位和测定值的关系
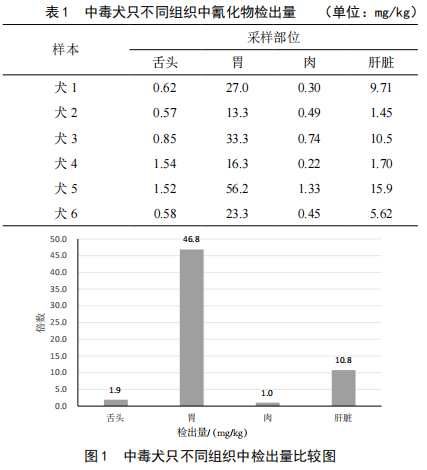
分析测定结果发现,肉中氰化物检出量最低,舌头氰化物检出量是肉中的1.9倍,肝脏氰化物检出量是肉中的10.8倍,胃中氰化物检出量是肉中的46.8倍,胃中氰化物检出量最高,具体如表1和图1所示。
氰化物在犬只各组织中的分布情况和氰化物的中毒机理有明显的关系。氰化物中毒非常快速,且致死量很低。毒物进入犬只体内后,还没有被完全消化和吸收,即可引起犬只中毒死亡,所以在胃部残留了大量的氰化物。肝脏虽然是解毒器官,但慢性中毒时,毒物蓄积会比较明显。氰化物在肝脏中残留量的影响因素比较复杂,不同的犬只其相对含量差异较大,但是均比肉中含量高。所以针对氰化物等在食品生产销售中非法使用的物质的检测,若采集肌肉等器官送往检测机构检测,结果往往是未检出。市场监督管理部门无法准确辨别犬只是否为氰化物所毒杀,不法分子将有机可乘。这也是市场上氰化物毒杀犬只屡禁不绝的一个重要原因,给消费者带来了巨大的威胁[7-8]。
2.2 存储温度和测定值的关系
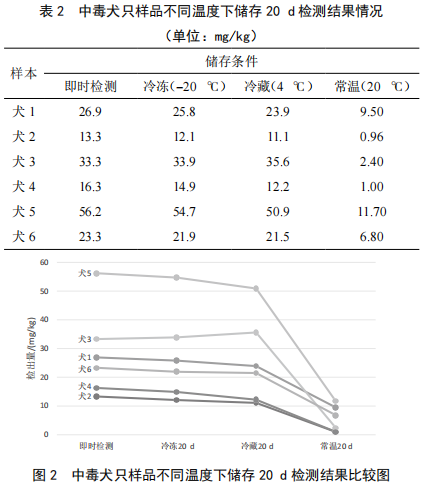
冷冻保存和冷藏保存的样品测定值与样品的采集当天的数据没有明显的差异,而常温保存的样品其测定值明显偏底,仅为采样当天的6%~35%,见表2和图2。
本试验证明样品应该保存在冷藏和冷冻的环境中,氰化物在冷藏或冷冻的环境中20 d内能保证较为稳定的含量值,如长时间放置在常温的环境中,测定的数据将会偏低,不能真实反应送检的样品的实际含量。在常温的环境中,样品有明显的腐臭味,颜色变黑,胃及内容物的混合物中氰化物以氢氰酸、氰化钾、有机氰化物等形式存在,微生物能降解一部分氰化物,氢氰酸在高温环境中也从样品中溢出,导致测定结果明显偏低,对于含量本来不高的样品,可能无法检测出来,样品也失去了其代表性。样品由采样人员采集后,如何进行有效的保存和运输,也就是确保分析目标物不损失和降解,是由样本的本质和分析方法决定的。如对储存的温度、空气、光照等条件的有效控制。针对氰化物样品的环境条件的要求,采样单位应配备冷链设施。
2.3 检测时间和测定值的关系
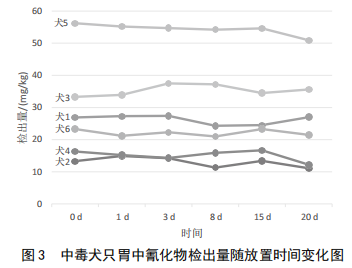
在冷藏(4 ℃)条件下,不同放置时间的毒犬只胃中氰化物的测定结果显示,相对偏差为5.5%~11.8%,数据的差异性不明显。由图3也清楚显示冷藏的环境中样品中氰化物并没有随着时间的变化发生明显的下降趋势,比较稳定。检测过程中样品稳定性给检测结果的可靠性带来了有利的因素,另外,氰化物在低温的环境中降解速度较慢,使食用该样品的危险因素长期存在[9]。
样品从采集完成到送检检测机构,其中有运输和存储的时间,检测机构从受理样品到开始检测也存在时间差。合理安排和控制检测时间,是影响样品测定结果的重要因素,也是确保数据有良好复现性的重要前提。试验结果表明在冷藏条件下氰化物测定从采样到检测时间控制在20 d内,测定结果差异不显著。
3 结论
样品具有代表性、真实性是食品检验中对样品的基本要求,这是保证检验结果准确可靠的重要前提。很多检验工作者在其论文中阐述了样品管理在检验检测工作中的重要性,及如何取保样品有效性的方法。科学规范地采集氰化物中毒犬只样本尤为重要。在对氰化物中毒的犬只取样过程中,应注意氰化物在全身的分布情况,选取有代表性的部位进行送检,胃部、肝脏中含量较多,肌肉和口腔等残留较少。
样品在采集后保存条件的控制也是检验流程的重要组成部分。本试验设置了冷冻、冷藏和常温3个不同的存储条件,对其结果差异性进行了分析研究,发现冷藏和冷冻保存的样品数据稳定,常温下保存样品氰化物含量有明显的降解。本试验中,在对所有样本冷藏保存20 d内含量变化趋势监测中没有发现明显波动,可见此稳定下氰化物降解较为平稳缓慢,降解率在12%之内。所以氰化物中毒的犬只样本应该保存在冷藏或冷冻的条件下,并在20 d内完成实验室检测,有助于确保检测结果的准确可靠[10-11]。
参考文献
[1]李云鹏,董兆君.血液中氰化物检测研究进展[J].国际检验医学杂志,2007,28(5):457-458.
[2]朱晓莉,王涤新,翟明芬.急性氰化物中毒36例临床分析[J].中国职业医学,2011,38(1):41-43.
[3]饶治,王冲,李思红.农产品质量安全例行监测抽样规范研究[J].江西农业,2019,(8):129-130.
[4]张晓红.水中氰化物测定关键环节分析[J].科技创新与应用,2017(16):173.
[5]金岚.异烟酸-巴比妥酸法测定狗肉中氰化物[J].理化检验(化学分册),2005(6):432-433.
[6]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中氰化物的测定:GB 5009.36—2016[S].北京:中国标准出版社,2016.
[7]明双喜,吴裕健,于艳艳,等.食品检验中样品管理的注意事项[J].食品安全质量检测学报,2019,10(16):5239-5244.
[8]刘向峰.检测实验室样品管理工作综述[J].实验室科学,2016,19(1):184-186.
[9]袁杰,徐景和.《中华人民共和国食品安全法》释义
[M].北京:中国民主法治出版社,2015.
[10]张春梅,马巧云,时晓敏.食品样品的采集、初级制备与保存[J].食品安全质量检测学报,2019,10(14):4461-4464.
[11]朱云华.浅谈检验检测实验室的样品管理[J].中国食品,2018(12):139-140.
热点推荐
-

主要食品配料厂商携手支持可持续农业
-

别样肉客在华推出脆香酥炸植物基蟹饼,为新春佳节增添美食新选
-

ADM首度亮相FBIF2023,探索食品饮料的今天、明天和未来
-

专访婴儿水团体标准制定者:为何为婴儿饮用水制定更高标准?
-

使用梅特勒-托利多X光机的五大理由
-

广西发动全区3·15食品安全“你点我检 服务惠民生”问卷调查
-

河南全省食品安全监管工作会议在鹤壁召开
-

万里挑一的“进博TOP好物”,三养创新产品与食安承诺受赞誉
-

河南省餐饮食品安全“总监话总监”巡讲活动在洛阳启动
-

郑州市举办2024年“质量月”质量诚信进商超暨质量提升交流观摩会
-

仁和中方医药股份联合民生大药房送健康捐赠活动在郑州举行
-

三养密阳工厂深度揭秘:火鸡面的食品安全与品质卓越之道
-

郑州市金水区召开学校食堂承包经营企业 食品安全行政指导会
-

陕西省举办全省学校食堂食品安全管理及投诉处置现场会
-

山西省局举办质量提升行动助力汾酒专业镇高质量发展活动
-

郑州市金水区开展肉类产品质量安全专项整治
-

郑州市市场监管局开展网络餐饮服务食品安全行政指导工作
-

西藏山南市率先将“两个责任”进党校 推动食品安全社会共治
-

湖北:开展校园食品安全和“五一” 期间食品安全监管工作
-

河南省政府食品安全办召开2024年夏季食品安全形势会商会议
-

山西省局召开食品安全抽检承检机构任务部署会
-

南昌市开展春节前食品经营安全监督检查
-

河南省汝南县:“你点我检服务惠民生”护航“双节”食品安全
-

湖北省局推动共建“外卖小哥食堂” 让外卖骑手暖心又暖胃
-

焦作市校园食品安全排查整治专项行动动员部署会召开
-

汝南县市场监管局“四个抓手”提升集中用餐单位食品安全水平
-

山西省市场监管局食品案件查办指导中心正式挂牌运行
-

河南省汝南县市场监管局多措并举开展学校食堂食品安全评价
-

恩施州市场监管局服务第八届世界硒博会
-

开封市市场监管局2023年食品抽检工作质量提升推进会召开





