QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中的氯霉素类兽药残留
2021-11-29 14:07:44 来源:
QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中的氯霉素类兽药残留
何 江
(贵阳市农产品质量安全监督检验测试中心,贵州贵阳 550081)
作者简介:何江(1984—),男,汉族,贵州织金人,硕士,高级农艺师。研究方向:食品检测和质量安全。
摘 要:目的:建立了QuEChERS方法结合高效液相色谱-串联质谱测定鸡蛋中氯霉素类兽药残留分析方法。方法:鸡蛋样品以80%乙腈水提取,加入盐析剂处理,取上清液经C18净化,UPLC-MS/MS测定。结果:目标化合物在0.010~0.100 µg/mL浓度范围内线性关系良好,相关系数R≥0.991,检出限和定量限分别为0.505~0.750 µg/kg和1.683~2.500 µg/kg。在0.01 mg/kg添加水平下,氟苯尼考胺、氯霉素、氟甲砜霉素的平均加标回收率范围在76.5%~108.0%,相对标准偏差(RSD)范围在5.33%~6.01%。结论:本方法快速、简便、准确,可用于鸡蛋中氯霉素类药物的残留测定。
关键词:QuEChERS;超高效液相色谱-串联质谱;鸡蛋;氯霉素
鸡蛋营养丰富,富含优质蛋白质、维生素和矿物质等,是餐桌上常见的食品。氯霉素类抗生素具有广谱性,能有效治疗动物疾病。但是,氯霉素存在严重的毒副作用,如能抑制人体骨髓造血功能,引起人体的再生障碍性贫血,粒状白细胞缺乏症[1]。由于氯霉素类药物价格低廉,疗效好,在畜禽养殖过程中会残留在鸡蛋中,对人们的健康和环境构成严重危害,我国已经明确规定氯霉素不得在鸡蛋中检出[2]。
QuEChERS前处理方法具有快速、简便、廉价、有效、耐用、安全等特点,是近年来应用广泛的样品前处理技术,常常用于兽药残留分析。氯霉素类药物的测定方法主要有气相色谱法[3]、气相色谱-质谱法[4]、液相色谱-串联质谱法[5]等,其中超高效串联质谱法具有分析速度快和灵敏度高的特点。本研究在QuECHERS方法的基础上,对提取溶液种类和净化剂含量等参数进行了优化,结合UPLC-MS/MS测定,建立了一种快速、有效、简便的测定鸡蛋中氯霉素类药物的方法。
1 试验部分
1.1 仪器与试剂
仪器:MixOne数显涡旋振荡器(合肥艾本森科学仪器有限公司);高速离心机(日本Hitachi Limited公司);FSH-2可调高速电动匀浆机(上海天由仪器科技有限公司);Milli-Q超纯水净仪(美国Millipore公司);超声波清洗器(浙江纳德科学仪器有限公司);Waters XEVO MS超高效液相串联质谱仪(美国Waters公司)。
试剂:氯霉素、氟苯尼考和氟苯尼考胺标准品溶液
(100 µg/mL)(北京坛墨质检科技有限公司);乙腈、甲酸和甲醇(HPLC级,美国德国MERCK公司);实验室用水为Milli-Q超纯水;十八烷基键合硅胶填料(C18)和石墨化炭黑(GCB)(美国Agilent公司)。
1.2 试验方法
1.2.1 标准溶液配制
分别吸取浓度为100 µg/mL标准溶液(氯霉素、氟苯尼考和氟苯尼考胺),用甲醇配制成浓度为2.0 µg/mL的混合标准储备液。准确吸取适量混合标准储备液,用空白提取液稀释成浓度为0.01 µg/mL、0.02 µg/mL、0.04 µg/mL、
0.08 µg/mL和0.10 µg/mL的基质混合标准溶液,流动相(甲醇∶水=10%∶90%)稀释成浓度梯度为同系列浓度的溶剂混合标准溶液。
1.2.2 样品前处理
称取鸡蛋样品2.00 g(精确至0.01 g)置于50 mL离心管中,加入10.0 mL乙腈-水(8∶2,V/V)(含0.1%甲酸)提取,高速匀浆,静置5 min,加入1 g MgSO4和1 g NaCl,剧烈振荡3 min后,超声提取10 min,10 000 r/min离心
10 min,取上清液于5 mL离心管中,加入10.0 mg固相萃取填料C18进行净化,10 000 r/min离心10 min,过0.22 µm滤膜后,UPLC-MS/MS测定。
1.2.3 色谱条件
色谱柱:Waters BEH C18(100 mm×2.1 mm,1.7 µm);流动相:A为0.1%(V/V)甲酸水溶液,B为甲醇。梯度洗脱程序:0~3 min,20% B;3~5 min,80% B;5~
8 min,100% B;8~10 min,10% B。流速:0.2 mL/min;进样量:5 µL。
1.2.4 质谱条件
离子源:电喷雾电离源(ESI);负离子模式扫描(氟苯尼考胺为正离子模式);多反应监测(MRM);电喷雾电压:3.5 kV,离子源和离子化溶剂温度分别为150 ℃和500 ℃,离子化和锥孔气体流量分别为1 000 L/h和50 L/h。质谱参数见表1。


2 结果与讨论
2.1 提取溶剂的选择
本研究考察了6种提取溶剂的提取效果,分别为90%甲醇水、80%甲醇水、70%甲醇水、90%乙腈水、80%乙腈水和70%乙腈水。结果表明,含有甲醇组的提取液色素干扰严重,蛋白沉淀效果差,影响目标物提取,回收率均在60%以下。乙腈组织渗透力和沉淀蛋白质能力强,本试验选取乙腈作为提取溶剂。提取剂中加入水的含量对目标物氟苯尼考胺的提取有显著影响,其中提取剂中含水量为10%和20%时,氟苯尼考胺回收率无差异,当提取剂中含水量下降到30%时,氟苯尼考胺的回收率从90%下降为50%。为了减少有机溶剂乙腈的用量,节约成本,因此,选择乙腈-水(8∶2,V/V)为提取溶剂,提取回收率在76.5%~108%,按照GB/T 27404—2008准确度要求,该方法满足农药残留检测的要求。
2.2 净化剂的选择
C18可以去除提取液中非极性物质,降低干扰和减小基质效应,提高分析结果的准确性和重现性;GCB可以消除色素对试验结果的干扰和质谱离子化的影响。本文分别考察了加入5 mg、10 mg、20 mg和30 mg的C18加入量对目标物的影响。研究证明C18为20 mg,添加浓度为0.01 mg/kg时,氯霉素、氟苯尼考和氟苯尼考胺的回收率范围在76.5%~108%。同时,当在20 mg C18中加入
20 mg GCB时,氯霉素、氟苯尼考和氟苯尼考胺的回收范围为75.6%~92.4%,为了节约成本和减少试验步骤,本研究选择不加GCB。因此,本研究选择净化剂为C18,添加量为20 mg。
2.3 色谱-质谱条件选择及优化
在相同梯度洗脱条件下,考察了流动相甲醇-0.1%甲酸水溶液和乙腈-0.1%甲酸水溶液对氟苯尼考胺、氯霉素和氟甲砜霉素的分离度、灵敏度和峰型的影响。试验表明,以乙腈水体系为流动相时,氟苯尼考胺保留时间小于
0.5 min;以甲醇水体系作为流动相时,氟苯尼考胺能有效保留,保留时间为1.27 min,本研究选择洗脱能力弱的甲醇体系,图1为氯霉素类药物在甲醇体系的MRM色谱图。
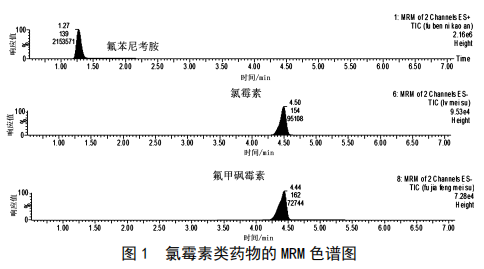

氯霉素类药物用甲醇配制成浓度为200 µg/L,质谱注射泵直接进入质谱进行MS扫描,优化毛细管电压寻找母离子;优化碰撞能量,选择响应高和干扰小的子离子作为定量离子。电离模式、定量离子对、定性离子对、碰撞能量及锥孔电压见表1。
图1 氯霉素类药物的MRM色谱图
2.4 基质效应、检出限和定量限
配制基质匹配混合标准溶液,UPLC-MS/MS进行检测。在0.010~0.100 µg/mL范围内溶剂和基质匹配标准曲线的线性相关系数R≥0.991。以定量离子的信噪比S/N=3和S/N=10分别计算检出限(LOD)和定量限(LOQ)[6],氯霉素类化合物在鸡蛋基质中的检出限(LOD)和定量限(LOQ)分别为0.505~0.750 µg/kg和1.683~2.500 µg/kg,结果见
表2。
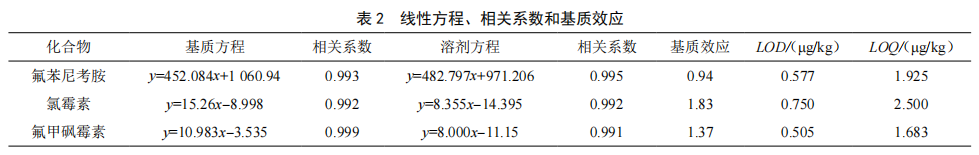

在UPLC-MS/MS检测复杂样品时,易受样品基质的干扰,影响目标物的离子化,产生增强或抑制效应,称为基质效应(Matrix Effect,ME)[7]。基质效应=基质匹配校准曲线的斜率/溶剂标准校准曲线的斜率,比值越接近1,则基质效应越小;比值在0.8~1.2范围内,则表明基质效应不明显。基质效应见表2,除氟苯尼考胺外,氯霉素和氟甲砜霉素在鸡蛋中基质效应较为明显,因此采用空白基质匹配标准曲线以降低基质效应的影响。
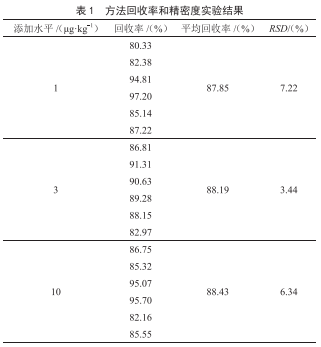
2.5 回收率与精密度
选择空白鸡蛋样品,在0.01 mg/kg添加水平下,进行6次平行试验。采用基质匹配标准曲线进行定量分析,氯霉素类药物在鸡蛋基质中的回收率与相对标准偏差结果见表3。氟苯尼考胺、氯霉素、氟甲砜霉素的平均加标回收率范围在76.5%~108.0%,相对标准偏差(RSD)范围在5.33%~6.01%,符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)[8]。


2.6 实际样品测定
随机选取超市和养殖场的动物源性食品,包括超市鸡蛋12份和养殖场21份,共33份样品,运用所建立的方法对样品进行检测,同时做方法对比,运用国标方法《动物源性食品中氯霉素类药物残留量测定》(GB/T 22338—2008)[9]。结果显示,所测的33份鸡蛋样品均未检出氟苯尼考胺、氯霉素和氟甲砜霉素。
3 结论
本文利用QuEChERS方法结合超高效液相色谱-三重四极杆质谱法,建立了鸡蛋样品基质中氯霉素兽药残留的测定方法。该方法快速、简便、灵敏,能够对样品中的目标化合物进行准确的定性和定量分析,采用基质匹配校正曲线定量,能最大程度地消除基质干扰,使检测结果更加精确,适用于动物源性食品鸡蛋中兽药残留的快速检测。
参考文献
[1]武书庚.鸡蛋的营养价值和对人体健康的益处[J].养生大世界,2020(9):80-81.
[2]崔荣飞,赵兴鑫,田梅,等.动物源性食品中非法添加物残留危害及检测技术[J].今日畜牧兽医,2019,35(12):1-3.
[3]郭军,王文兰,赵全东,等.气相色谱法测定水产品中氯霉素残留的不确定度评定[J].食品安全质量检测学报,2018,9(23):6216-6220.
[4]张春辉.气相色谱质谱法同时测定动物组织中盐酸克伦特罗、莱克多巴胺及氯霉素[J].企业科技与发展,2020(9):79-81.
[5]黄建芳.QuEChERS/高效液相色谱-串联质谱法同时测定大黄鱼中五氯酚及氯霉素类药物残留[J].现代食品,2020(21):170-173.
[6]郭学桃.化学检测中检出限的测定与运用[J].大众标准化,2018(5):42-45.
[7]周剑,王敏,杨梦瑞.液相色谱质谱分析中的基质效应研究[J].农产品质量与安全,2018(1):67-70.
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.实验室质量控制规范 食品理化检测GB/T 27404—2008[S].北京:中国标准出版社,2008.
[9]国家质量监督检验检疫总局.动物源性食品中氯霉素类药物残留量测定GB/T 22338—2008[S].北京:中国标准出版社,2008.
热点推荐
-

使用梅特勒-托利多X光机的五大理由
-

小个头 大营养 禾泱泱有机稻鸭原生小泱胚芽米 金秋喜迎初丰收
-

全球食品创新平台第五期已启动,携手共创安全、健康、绿色的未来
-
特医食品不是药,却是临床治疗的关键支撑
-

“喂饱”体内的益生菌,肠道更健康
-

QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋中的氯霉素类兽药残留
-
食品微生物检验实验室质量控制——以陕西嘉禾药业有限公司为例
-
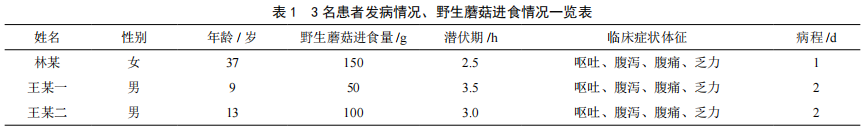
安溪县一起青褶伞中毒事件的调查
-

哈市市场监管局执法“巡回讲堂”走进哈新区
-

利用色谱方法鉴定葡萄酒中掺假组分
-
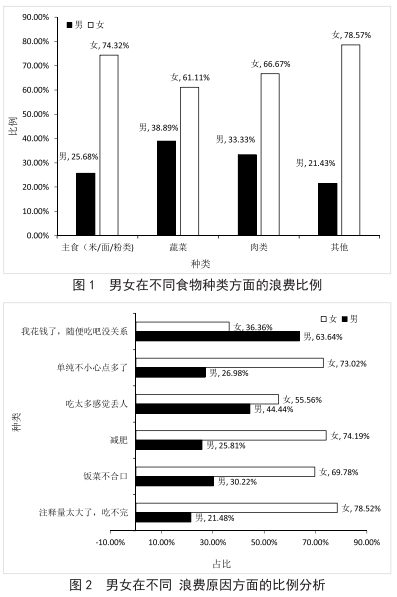
高校反食品浪费方式的探析——以广州新华学院为例
-

食品农药残留检测中样品前处理技术探究
-

烘烤对面包质量的影响
-

杏仁胡萝卜酥性饼干的工艺研究
-
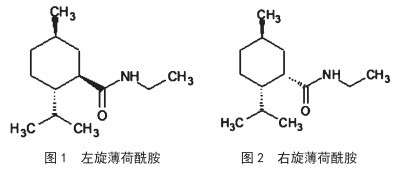
左旋薄荷酰胺的提纯工艺研究
-

湿法消解-原子荧光法测定海产品总砷方法的改进
-

木瓜蛋白酶处理对牛肉品质影响的研究
-
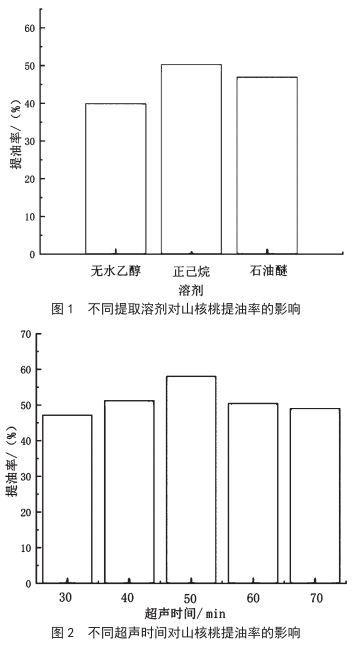
超声波辅助提取山核桃油工艺的研究
-
家庭自制酵素中的微生物污染检测
-

凯里酸汤-白酸汤产品检测及标准制定
-
肉猪体内组织和体液中多西环素含量的相关性研究
-
一起因食用韭菜饼引起亚硝酸盐食物中毒原因的实验室分析
-
茯砖茶中特征挥发成分分析
-

GC-MS/MS法测定芹菜中毒死蜱残留量 不确定度评定
-
免疫亲和柱-高效液相色谱法测定饼干中赭曲霉毒素A的含量
-

国际FAPAS乳粉中金黄色葡萄球菌定量检测能力验证结果与分析
-

液相色谱-串联质谱法测定芝麻油中乙基麦芽酚
-
微波消解-ICP-MS和高压封闭消解-ICP-MS测定农产品中16种元素的方法研
-

高效液相色谱法测定饮料中的阿力甜含量
-

双歧杆菌在婴儿配方奶粉中的稳定性研究





