食品中黄曲霉毒素B1检测方法研究
2019-02-18 17:12:10 来源: 食品安全导刊
□ 张宏博 靳志敏 高智慧 郑玉山(通讯作者) 内蒙古自治区食品检验检测中心
摘 要:黄曲霉毒素(AF)是广泛存在于自然界中的真菌毒素,而在所有的真菌毒素中,AFB1的毒性、致癌性较大,其能阻止蛋白、酶和凝血因子合成,又能抑制葡萄糖、脂肪酸、代谢产物的合成,从而引起免疫抑制、脂肪退化和DNA损伤。AFB1的检测方法大致分为化学分析法、生物鉴定法、仪器分析法三大类,本文主要对运用较为广泛的TLC(薄层层析)、HPLC(高效液相色谱)、GICA(胶体金标免疫层析分析法)、ELISA(酶联免疫法)检测方法进行论述。
关键词:黄曲霉毒素 毒性 致癌性 检测方法
1 黄曲霉毒素概况及其发病机理
黄曲霉毒素(AF)主要成分是由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)产生的有毒性的次生代谢产物,属于真菌毒素,广泛存在于自然界中[1,2]。黄曲霉毒素由大约18种化学结构相似的衍生物组成,包括B和G两大类,植物性食物中产生B1、B2、G1和G2[3],而乳或乳制品(包括乳酪、奶粉等)中产生M1、M2。黄曲霉毒素B1在植物性食物衍生组中毒性最强,其慢性毒性甚至可诱发肝癌。
AF需要在机体内代谢活化才能表现出毒性。首先,细胞内的多功能氧化酶将AF催化成环氧化物;然后,环氧化物与大分子反应生成DNA、RNA、蛋白质和类脂的结合物,并表现出两种毒性——急性毒性和慢性毒性,分别表现为AF与蛋白质(包括酶)、类脂的反应可导致细胞的死亡,与核酸的反应可导致突变。研究表明,在所有真菌毒素中,AFB1的毒性、致癌性最大——能阻止蛋白、酶和凝血因子合成,又能抑制葡萄糖、脂肪酸、代谢产物的合成,从而导致免疫抑制、脂肪退化和DNA损伤[4]。
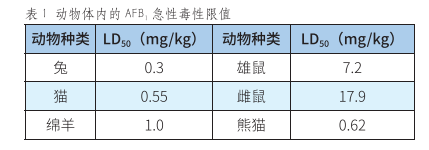
AFB1在动物体中的急性毒性如表1所示,其毒性因动物年龄、种类、性别而异[5]。一般来说,幼年动物对AFB1的敏感性要大于成年动物,雄性动物的敏感性要大于雌性动物。研究表明,当猪饲料中AFB1的含量达到810ppm时,饲料的转化率下降,猪的体重也明显下降,甚至会出现死亡,解剖发现其肝脏出现退行性变化,肝细胞大面积坏死。AF除了会对大鼠引起肝癌外,还会使大鼠患上胃癌、结肠癌和肾脏上皮癌[6]。
人体摄入被AF污染的食物后经消化道吸收,其大部分积累在肝脏,少部分分布在肾脏、血液和肌肉中,在机体内通过羟基化、去甲基化和环氧化等作用形成代谢产物使机体致癌、致突变。研究表明,AF的LD50(半数动物致死量)为0.249mg/kg,毒性比氰化钾高10倍[7]。AFB1在人体内的危害表现为急性毒性和慢性毒性,急性毒性在人体内会出现肝实质细胞坏死、胆管上皮细胞增生、肝脂肪浸润及肝出血等[8],前期症状为发烧、呕吐、黄疸,继而出现腹水和下肢浮肿,最终可导致死亡。AFB1是一种能导致人体遗传物质发生变化的致突变化合物,其在人体的代谢产物有致突变作用,包括AFB1-2,3-环氧化物、AFM1和AFP1等,其中AFB1-2,3-环氧化物的第2个碳与DNA的鸟嘌呤酮基结合形成AFB1-DNA加合物,去嘌呤反应通过形成AFB1-N7-鸟嘌呤,使DNA分子产生无嘌呤位置的缺口,从而造成DNA损伤,进而可能导致癌变。致癌性表现为AFB1可引起细胞错误地修复DNA,从而导致严重的DNA诱变,并进一步抑制DNA和RNA的合成,最终抑制蛋白质的合成及基因变化积累[9,10]。目前,科学家已证实p53基因是癌症的抑制基因,很多人可能在幼年时就受到AFB1的攻击,加之人体内特定基因的缺失或变异引起p53基因突变,最终导致机体发生癌变[11]。
由于AFB1具有危害性和广泛性,人们需要有效的检测方法测定其在食品中的含量,确保对人和家畜的伤害降到最低。目前检测AFB1的方法很多,但主要分为三大类:化学分析法、生物鉴定法、仪器分析法[12-14],其中有4种方法的运用较为广泛,即TLC(薄层层析)、HPLC(高效液相色谱)、GICA(胶体金标免疫层析分析法)、ELISA(酶联免疫法)。
2 食品中AFB1的几种检测方法
2.1 薄层层析法(TLC)
AF是低分子量极性化合物,它的特点是可以吸收紫外光,利用这一特点衍生了多种测定AF的方法,而薄层层析方法是最早被运用的方法。薄层层析法(TLC)同时具有定性和定量的分析功能,所以被美国官方确定为标准方法,我国也在国家标准中将其确立为仲裁法[15]。TLC的原理是利用AFB1在365nm紫外波长下会发出蓝色荧光的特点,再经过固相层分离后,对其荧光的强度进行测定,并且与标准液相比,最终得出结果。这种方法不需要专门的仪器设备,成本低,实验室大都能完成对AF的测定。但是,最原始的薄层分析由于分辨率不稳定,受周围因素的影响很大,检测结果不稳定,差异性较大。同时,该方法的工作量比较复杂,耗费时间较长,且在做定量分析时精确度较低。现如今,随着科技的迅速发展,出现了很多固相吸附材料,可以使薄层层析的准确度得到提升,其精确度甚至可以与高效液相色谱相较量。张慧丽等通过用黄曲霉菌株接种18种花生仁,利用半定量薄层层析法和精确定量高效液相色谱法检测到的AF质量浓度确定花生的抗AF合成的能力,鉴定出2个高抗黄曲霉感染和AF质量浓度低的花生品种[16]。
2.2 高效液相色谱(HPLC)
1986年,AOAC International首次将高效液相色谱法(HPLC)作为检测乳液中AFM1及AFM2公认的方法[17],也是国内外研究机构认为检测AF最权威的一种方法,其具有分析自动化的潜力,且具备灵敏度高、精确度高等优点[18]。但是,HPLC对样品的纯度要求很高,必要时需将原料进行衍生才能使用这种方法。经长期研究实践,研究人员总结出一些使用该方法的技巧。AF的荧光特性受流动相中的液体影响较大,只能检测到1~2种AF,有的甚至会发生荧光猝灭现象,所以在测定时要同时运用紫外检测器和荧光检测器才能将试样中的AF检测完全。此外,国内外学者也对高效液相色谱法测定AF进行了系统的研究。陆勤佳等人基于高效液相色谱荧光法设计并完成了一套由分离系统、恒温控制系统、荧光检测器、主控板和人机交互界面组成的AF检测系统,并且经过测试,表明该AF检测系统具有良好的稳定性——结构紧凑、检测速度快且灵敏度高,能用于AF的实际检测[19]。王勇建立AFB1的柱前衍生-高效液相色谱(HPLC)检测方法,该方法具有良好的准确性、灵敏性和重复性,可对组织样品中AFB1残留量进行快速准确分析,为AFB1在食品中的快速检测奠定基础[20]。Beaver R、Klaus R等研究发现,在柱后衍生时向其中加入碘,会增强AFB1的荧光度——是之前的25倍,该方法已经被运用到花生制品AFB1的含量检测中[21,22];该方法需要使用的仪器非常昂贵,一般在进出口检测实验室使用。罗朝权等为建立一种快速检测动物类药材污染AFB1(AFB1)和AFG1(AFG1)的液质联用法,并用于水蛭等6种动物类中药材污染情况的分析,结果表明,土鳖虫等动物类药材受AF污染的情况较为严重[23]。
2.3 酶联免疫法(ELISA)
酶联免疫法在1971年以后开始被运用到实验中,成为检测食品中AFB1最简单、方便的方法之一。ELISA的原理是利用抗原与抗体之间的高度特异性和酶的高效催化性,抗原或抗体与某种载体结合,在检测时样品中的酶标抗原抗体与载体上的抗原或抗体会发生反应,产生抗原抗体的复合物,通过添加酶使产生的物质快速显现颜色,且AF的含量越高,底物的颜色越浅,从而达到检测的目的,是一种可以定性定量分析的方法[24,25]。该方法的关键点首先是抗原或抗体在检测的过程中要一直保持活性,并且还可以与载体相结合;其次是酶在检测的过程中要始终保持活性,即使是与抗原或抗体结合后,仍能发挥出酶的催化作用,但这种酶容易受温度等多种因素的影响,所以一般将其在低温下保存。常用的ELISA有直接法、间接法、双抗体夹心法、竞争法、抑制性测定法等[26,27]。胡竹行等研究了酶联免疫法检测大曲中AFB1的提取条件,结果表明,在甲醇浓度为55%(v/v)、提取时间为25min、功率为200W时,其提取率明显高于国家标准[28]。当前,为了更加方便而利用ELISA研发出酶联免疫法分析试纸盒,并且已经商业化生产,为人们的生活提供便利。酶联免疫法分析试纸盒没有改变原理,且检测的准确性十分可靠,该方法目前被广泛用于饲料原料中检测AFB1的含量。李江等用酶联免疫法对食用油中AFB1的测定结果与液相法比较,符合率高,能够用于食用油中AFB1的快速、准确检测[29]。
2.4 胶体金标免疫层析分析法(GICA)
纳米金是直径1~100nm的金微小粒子,是一种带负电的疏水胶体。胶体金标免疫层析分析法就是利用纳米金作为标记底物,所需检测时间较短,可直接读取检测数值,且该方法不需要对试样进行分离提纯处理,也不用对检测溶剂做处理,操作起来简便且高效[30],是目前最简单、最快速的检测方法之一。GICA会使试样中的AF与偶联胶体金的抗AF抗体相结合,无论是结合的还是非结合的抗体都会沿着膜的移动,通过固定化的真菌毒素组成的检测线,它将结合游离的抗体,以形成可见的线,以此来表示AF的污染低于试验的阈值[31]。人们对于纳米金的研究已经有很长的时间,并在多个领域得到运用。宋青龙等用胶体金免疫层析技术,结合胶体金定量读数仪研制出一种检测方法简便、快速、稳定性好,样品检测结果与高效液相色谱法检测结果的相对误差在20%以内,快速定量检测谷物和饲料中AFB1含量的胶体金快速定量检测试剂盒[32]。刘晓玥等通过用胶体金免疫层析法和酶联免疫吸附法对饲料样品的检测进行对比,结果表明,胶体金免疫层析试纸条法与酶联免疫吸附法相符率可达95%以上,说明该方法操作简单、快速、方便,可以应用于谷物及饲料产品AFB1现场快速检测[33]。
3 小结
AF是广泛存在于自然界中的真菌毒素,运用较为广泛的检测方法有4种——薄层层析法是最早被运用的方法,该方法同时具有定性和定量的分析功能,但随着科技的发展迅速,如今出现了很多固相吸附材料,使薄层层析的准确度也随之上升,其精确度甚至可以与高效液相色谱相较量;高效液相色谱法对样品的纯度要求很高,但具有分析自动化的潜力,以及灵敏度高、精确度高等优点;酶联免疫法的特点是特异性强、灵敏度高、快速、简便及无污染;而在荧光素、酶、同位素及乳胶标记技术之后,纳米金已经成为的一种新型标记技术[34]。
参考文献:
[1] 陈宁庆.实用生物毒素学[M].北京:中国科技出版社,2001:251-275.
[2] 夏世钧,吴中亮.分子毒理学基础[M].湖北:科学技术出版社,2001:170-175.
[3] 王瑞鑫,张微,李书国.免疫传感器在粮油中真菌毒素快速检测的应用研究进展[J].粮油食品科技,2015,23(04):83-87.
[4] Denissenko M F, Cahill J, Koudriakova T B, et al. Quantitation and mapping of aflatoxin B1-induced DNA damage in genomic DNA using aflatoxin B1-8,9-epoxide and microsomal activation systems[J].Mutation Research/Fundamentaland Molecular Mechanisms of Mutagenesis,1999,425(2): 205-211.
[5] 任志.禽黄曲霉菌素中毒的诊断及防治[J].家禽科学,2015(11):60.
[6] 王凤荣,张祥宏,张振东,等.真菌及其毒素诱发肺癌的动物实验研究[J].北京大学学报(医学版).2003,1(35):1-8.
[7] 李金.有害物质及其检测[M].北京:中国石化出版社,2001:94-100.
[8] 吴丹.黄曲霉毒素在粮食和食品中的危害及防治[J].粮食加工,2007,32(03):91-94.
[9] CHAN K T,DENNIS P H,MARIA L L,et al.In vitro aflatoxin B1 induced p53 mutations[J].Canc Let,2003,199(1):1-7.
[10] PAUL C T,ABDOULAYE S,KUANG S K,et al.Absence of p53 Codon 249 mutations in young guinean children with high Aflatoxin exposure[J].Canc Epid Bio &Pre,2005,14:2053-2055.
[11] 许真,金银龙.环境致癌剂与p53基因突变[J].卫生研究,2004.33(2):239-243.
[12] 王叔淳.食品中黄曲霉毒素M1、B1的测定[M].食品卫生检验技术手册,北京:化学工业出版社,1994,251-252.
[13] 李明元.酶联免疫吸附测定法.食品卫生理化检验标准手册,北京:中国标准出版社,1998:292-293.
[14] 扬兆禄.色谱[J].1991,9(3):54.
[15] 杨惠芬.食品中黄曲霉毒素B,的薄层色谱法[J].食品卫生理化检验标准手册.化学工业出版社.1998:272-274.
[16] 张慧丽,杨松,苏君伟,于洪波,徐文杰,张丽男,姜忠良,孟宪军.黄曲霉菌感染花生的不同检测方法的应用[J].食品与生物技术学报,2013,32(08):868-874.
[17] Tabata S. Kamimura H.AFM] and M2-high performance liquid chromatography (HPLC) in milk.AOAC[M]. 1986.26.83-87.
[18] 王培之,徐克沂,皮国华.胶体金免疫结合试验在检验医学中的应用[J].中华检验医学杂志,2000,23(5):308-309.
[19]陆勤佳,蔡强,沈国金,王振华.黄曲霉毒素检测系统的设计与实现[J].电子器件,2017,40(03):748-753.
[20]王勇.黄曲霉毒素B1柱前衍生-高效液相色谱法检测方法的建立[J].大众标准化,2017(06):45-47.
[21] Beaver R.W,Wilson D.M. Comparison of postcollumn derivatization liquid chromatography with thin-layer chromatography for determination of aflatoxins in naturally contaminated corn [J]. AOAC . Int, 1990.73(4):579~581.
[22] Klaus R. Wolfgang M.F Determination of aflatoxins in medical herbs and plant extracts[J].Journal of chromatography A.1995,692,131-136.
[23]罗朝权,张敏玲,郑润生,蔡晓吟,徐晖,贠小芸,覃嘉良.6种动物类药材中黄曲霉毒素污染的液质联用检测[J].中国实验方剂学杂志,2018,24(03):67-71.
[24] S D Holladay.间接酶联免疫吸附试验检测黄曲霉毒素抗体的评价[J].贵州畜牧兽医,1993,17(1):46-47.
[25]赵晓联,赵春城,钮伟民,等.酶联免疫吸附法测定黄曲霉毒素B1误差分析[J].中国卫生检验杂志,2001,11(4);473-474.
[26]周先碗,胡晓倩.生物化学仪器分析与实验技术.北京:化学工业出版社,2003.
[27]陈建伟. 玉米中黄曲霉毒素的ELISA测定方法研究.
[28]胡竹行,沈才洪,敖宗华,王松涛,周军,曾娜,丁海龙,张强.大曲中黄曲霉毒素B1提取方法的研究[J].酿酒科技,2014(02):27-29.
[29]李江,綦艳,佘之蕴,廖桂福,陈满英.酶联免疫法对食用油中黄曲霉毒素B1的检测[J].广东化工,2017,44(11):73-74.
[30] 邓瑞广,孙开冬,慕桂香,等.胶体金免疫层析法检测猪旋毛虫病试验[J].河南农业科学,2006,4:97-99.
[31] 王岩.黄曲霉毒素M1化学发光酶免疫分析方法的研究[D].哈尔滨长春理工大学,2013.
[32]宋青龙,李成洪,傅巍,唐红梅,杨春柳,谯仕彦.黄曲霉毒素B1胶体金快速定量检测试剂盒的研发[J].动物营养学报,2017,29(10):3703-3709.
[33]刘晓玥,侯亚楠,吕丽卿.饲料中黄曲霉毒素B1快速筛查胶体金免疫层析检测方法应用研究[J].吉林农业,2017(18):64-65.
[34] Osikowicz G,Begge M.One-step chromatographic immunoassay for qualitative.
热点推荐
-

猛男的炒饭,三年开出两百多家分店!炒饭界的霸王!
-

2019《食品安全导刊》杂志订阅返百元红包!
-

食品安全谣言治理的法律分析
-

又一大省连续发生两起非洲猪瘟疫情!
-
9月大事 | 市场监管总局开展2018年全国“质量月”活动
-

超临界二氧化碳层析分离番茄红素和番茄籽油
-

食品中黄曲霉毒素B1检测方法研究
-

安科亮相analytica China 2018,吸引众多国内外粉丝
-

站在技术前沿,探讨行业发展新方向
-

动物源性成分快速鉴定——速芯科技
-

2018analytica China 媒体巡游活动完美收官!
-

水产品中硝基呋喃代谢物液相色谱串联质谱测定方法
-
鸭蛋菌落数及洁蛋加工
-
食品安全快速检测产品评价
-

微生物检测快检产品的先行者——食安科技
-

安科生物携微生物快检产品亮相中国第三方检测实验室发展论坛
-
液相色谱-串联质谱法检测饲料原料中维生素A、维生素D3、维生素E
-

微生物检测注意事项 ——大肠菌群和菌落总数
-

走进100家优秀实验室——浙江九安检测
-

走进100家优秀实验室——国联质检
-
气相色谱法测定西红柿中多种有机磷农药残留量
-

舌尖上的保卫者“酶抑制率法”
-
毛细管柱放置后分离度性能的检查
-

快检技术在禽蛋产品兽药残留 检测技术中的应用
-
2017年常州市保健食品质量监督抽检结果分析
-
盐酸克仑特罗快速定量检测试剂条研制(时间分辨微球法)
-
瘦肉精的毒害作用及其试纸快速检测技术
-

赛默飞世尔:推出全新的金属检测平台
-
HPLC法测定面包中 丙酸钙含量的不确定度评定
-

重金属元素检测中ICP-MS技术的应用





