食品添加剂L-香芹酮的吸入遗传毒性评价
2023-07-05 15:01:00 来源: 食品安全导刊
严大为1,李 睿2,陆诚玮1,高峄涵1*
(1.上海新型烟草制品研究院有限公司,基础研究室,上海 201315;
2.上海市食品药品检验研究院,药理毒理所,上海 201203)
L-香芹酮是留兰香油的主要成分,含量占比在50%~60%,具有很浓郁的留兰香香气,其在食品香精、牙膏、硬糖、口香糖和各种饮料中有着广泛的应用[1-2]。近年来,随着雾化平台的兴起,L-香芹酮等香精香料的使用方式可改变为雾化吸入的方式摄取。L-香芹酮虽是食品级添加剂,一定剂量内经口摄入较为安全,但其吸入途径的安全性却鲜有报道,尤其是关于L-香芹酮吸入途径的遗传毒性。
有报道称消费者在电子烟烟液中违规添加四氢大麻酚等物质,引起多起健康事件,添加剂的吸入安全性已引起广泛关注[3]。同时,有研究表明不同的电子烟烟液气溶胶的细胞毒性具有较大差异,且与电子烟烟液中的添加剂密切相关[4-7]。虽然THORNE等[8]开展了电子烟烟液气溶胶的Ames试验,结果显示受试菌株未发生基因回复突变。MANOJ等[9]也未观察到在与卷烟等同的特定剂量下电子烟烟液气溶胶会引起细胞毒性和遗传毒性的情况。同时,AZZOPARDI等[10]也证明电子烟烟液气溶胶的细胞毒性相对传统卷烟气溶胶的细胞毒性较小,但对单一添加剂的吸入途径的遗传组合毒性评价还未见报道,尤其是添加后对烟液气溶胶整体的遗传毒性影响。因此,本文拟采用气-液(琼脂)界面暴露的方式,选取TA97a、TA98、TA100、TA102和TA1535菌株和中国仓鼠肺细胞(CHL细胞)等受试体系,根据Ames试验、染色体畸变试验、体外微核试验等遗传毒性检测方法,本着风险最大化原则,选取美国香精和提取物制造商协会公认在烘焙食品中安全无毒使用L-香芹酮浓度的3倍(300 mg·L-1)[11],对含有L-香芹酮雾化剂参比烟液气溶胶的遗传毒性进行初步评估,并与雾化剂参比烟液气溶胶进行比较,为L-香芹酮添加剂的合理安全使用提供参考和支持。
1材料与方法
1.1材料、试剂和仪器
TA97a、TA98、TA100、TA102和TA1535菌株,来源于美国Moltox公司;中国仓鼠肺细胞,来源于中国科学研究院细胞库;A549人肺腺癌细胞,来源于复旦大学药学院。
琼脂粉(212304A级),美国BD公司;氯化钠(≥99.5%),海凌峰化学试剂有限公司;组氨酸(99%),北京百灵威科技有限公司;生物素(99%),北京百灵威科技有限公司;营养肉汤(CM1168B),英国OXOID公司;RPMI 1640细胞培养基(Lot2200921),美国Gibco公司;胎牛血清(Dbc0520),美国Hyclone公司;磷酸缓冲液(Lot2028925),美国Gibco公司;0.25%(w/v)胰酶-EDTA(0.25%),美国Gibco公司;丝裂霉素(99.7%),中国食品药品检定研究院;冰醋酸(≥99.5%),上海凌峰化学试剂有限公司;甲醇(≥99.5%),上海凌峰化学试剂有限公司;细胞培养皿(100 mm×20 mm),美国Corning公司;Tran swell培养板(12/24 mm),美国Costar公司;DMEM细胞培养基(Lot2120818),美国Gibco公司;无水乙醇(≥99.7%),国药集团化学试剂有限公司;DMSO(99.9%),美国Sigma公司;雾化剂参比烟液;上海新型烟草制品研究院有限公司配制;含300 mg·L-1 L-香芹酮的雾化剂参比烟液;上海新型烟草制品研究院有限公司配制。
X200AF吸烟机,上海帕夫曼自动化仪器有限公司;Mini Tank烟具,香港Mask King公司;LA2-6AX生物安全柜,新加坡ESCO公司;ECLIPSE TS100倒置相差显微镜,日本Nikon公司;BD240恒温培养箱,德国Binder公司;G-560E漩涡混合器,美国Scientific Industries公司;CKX41显微镜,日本Olympus公司;HERA CELL VIOS 160i CO2培养箱,美国Thermo Scientific公司;移液器(5 mL、1 mL和200 μL),德国Eppendorf公司;5810R离心机,德国Eppendorf公司;Vi-cell XR细胞活力分析仪,美国Beckman Coulter公司;U570超低温冰箱,加拿大New Brunswick公司;3K30离心机,美国Sigma公司;气-液界面暴露皿,英国BAT公司自制。
1.2试验方法
1.2.1细菌和细胞培养
取营养肉汤培养基5 mL,加入无菌试管中,将冷冻保存的TA97a、TA98、TA100、TA102和TA1535菌株培养物接种于营养肉汤培养基内,37 ℃下振荡(100次/min)培养10 h。
CHL细胞培养基为含有10%(/)胎牛血清的RPMI 1640培养基,培养条件为37 ℃、5%浓度的CO2加湿培养。
1.2.2气溶胶产生方式和暴露方式
将参比烟液(或含300 mg·L-1 L-香芹酮的参比烟液)装入Mask King电子烟烟具,烟具充电激活后,接入吸烟机。按照一定的抽吸模式(抽吸间隔30 s,抽吸流量55 mL,抽吸时间3 s,电子烟功率11.3 W)进行抽吸,在吸烟机和电子烟烟具间采用软管接入气-液界面暴露皿(图1),待细胞接种至Trans well培养板(或细菌接种至琼脂培养皿,然后将培养皿直接放入暴露小室)后,即可产生气-液(琼脂)界面暴露染毒,染毒时间为30 min(60口抽吸耗时,烟具单次充电最大抽吸口数),暴露的气溶胶浓度为电子烟烟液的全烟气[12]。
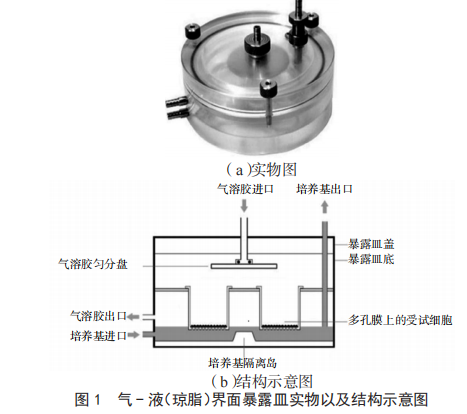
1.2.3遗传毒性检测方法
(1)Ames试验方法。Ames试验中,将含
0.5 mmol·L-1组氨酸和0.5 mmol·L-1生物素溶液的顶层琼脂培养基按照0.4 mL/管分装于60个试管中(共分为阴性对照组、阳性对照组、参比烟液组和含L-香芹酮参比烟液组,每组测试5个菌株,每个菌株
3个平行),45 ℃水浴中保温,每管依次加入试验菌株增菌液0.2 mL,PBS或者S9混合液(需代谢活化时)1.0 mL,阳性对照组加入阳性物质溶液(敌可松、叠氮钠、甲磺酸甲酯或2-氨基芴),充分混匀,取80 μL迅速倾入底层琼脂平板上,转动平板,使之分布均匀,置于培养箱,待平皿干燥后受试物组进行全烟气暴露。阴性对照组不作处理、阳性对照组给予各菌株的阳性对照品。暴露结束后置37 ℃培养箱内倒置培养72 h后观察结果。若阳性对照组的回复突变数是阴性对照组的3倍或3倍以上,则视为菌株阳性结果,如不符合,则视为阴性结果。
(2)染色体畸变试验方法。染色体畸变试验中,将CHL细胞接种在24 mm的trans well小室的顶侧,接种密度为2×105 cells/孔,1.5 mL/孔,底侧加入1.3 mL含有10%(/)胎牛血清的RPMI 1640培养液的培养基。细胞在37 ℃,5% CO2下培养24 h。阴性对照组不作处理;阳性对照组给予丝裂霉素(终浓度为0.2 μg·mL-1);处理组进行全烟气暴露。在细胞收获前4 h,每皿加入15 μL浓度为20 μg·mL-1的秋水仙素,使秋水仙素的终浓度为0.2 μg·mL-1。秋水仙素处理4 h后,弃去培养液,加入0.5 mL 0.25%胰酶-EDTA消化细胞。待消化结束后,加入一定量的完全培养液终止消化,终体积为10 mL。取约0.5 mL细胞悬液计数活细胞数。取剩下的细胞悬液离心后经0.075 mol·L-1氯化钾低渗、固定、滴片,干燥后Giemsa染色,干燥后封片待阅。记录染色体结构畸变细胞数和畸变类型,畸变类型包括断裂、缺失、交换、环状、三辐体、四辐体和粉碎等。裂隙和染色体数目畸变(多倍体和内复制)单独记录,不计入畸变率中。若细胞的染色体畸变率与阴性对照组存在显著性差异,则视为阳性结果,若不符合,则视为阴性结果。
(3)体外微核试验方法。体外微核试验中,将CHL细胞接种在12 mm的trans well小室的顶侧,接种密度为1.5×105 cells/孔,0.5 mL/孔,底侧加入
1 mL培养基。细胞在37 ℃,5% CO2下培养24 h。阴性对照组不作处理;阳性对照组给予丝裂霉素(终浓度为0.1 μg·mL-1);处理组进行全烟气暴露,暴露结束后继续培养24 h,然后弃去培养液,加0.2 mL的0.25%胰酶-EDTA消化细胞。待消化结束后,加入一定量的完全培养液终止消化,终体积为10 mL。取约0.5 mL细胞悬液计数活细胞数。取剩下的细胞悬液离心后经0.075 mol·L-1的氯化钾低渗、甲醇∶冰醋酸(3∶1)固定、滴片,干燥后Giemsa染色,干燥后封片,后在光学显微镜(100×10倍)下观察并计数500个细胞,分别计数其中单核、双核、三核、四核细胞的数量,每个剂量组计数1 000个双核细胞中出现微核的数量,并计算微核率。若细胞的微核率与阴性对照组存在显著性差异,则视为阳性结果,若不符合,则视为阴性结果。
1.2.4数据统计
Ames试验中,培养结束后,显微镜下观察培养皿中菌斑的生长情况,同时计数每皿的菌落数,结果以均数±标准差表示。染色体畸变试验中,畸变率=出现结构畸变染色体细胞/观察细胞数×100%,采用卡方检验进行统计分析。体外微核试验中,微核率=(含有微核的双核细胞数)/至少1 000个双核细胞总数×1 000,采用卡方检验进行统计分析。
2结果与分析
2.1 Ames试验结果
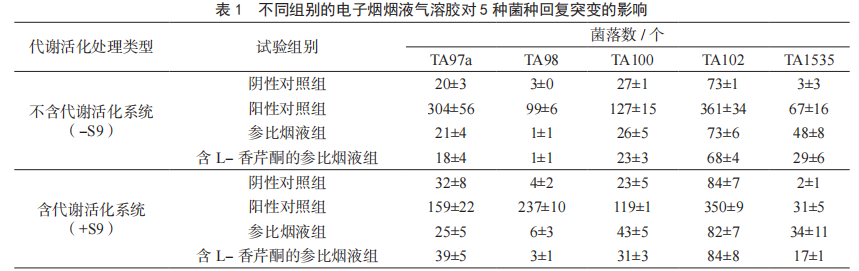
由表1可知,与阴性对照组相比,在有无代谢活化系统的情况下,阳性对照组所有菌株的菌落数均至少是阴性对照组的培养皿中的菌落数的3倍,试验系统有效,可检测出有致突变物质。暴露参比烟液气溶胶和含L-香芹酮的参比烟液气溶胶后,在有无代谢活化系统的情况下,菌株TA97a、TA98、TA100、TA102和TA1535背景菌斑均正常,培养皿中TA97a、TA98、TA100和TA102菌株的菌落数均未达到各自空白对照组培养皿中菌落数的3倍或者3倍以上,只有菌株TA1535菌落数超过空白对照组菌落数的3倍以上,结果为可疑阳性。与参比烟液组相比,在不含活化系统S9情况下,含L-香芹酮的参比烟液组的5种菌株的细菌突变菌落数降低幅度为0%~39.6%,而含活化系统S9的情况下,TA97a和TA102菌株的菌落数增加56.0%和2.4%,TA98、TA100和TA1535菌株的菌落数分别降低50%、27.9%和50%,L-香芹酮的添加改变了参比烟液的细菌突变菌落数,但增加或降低的变化幅度均在60%以下。
2.2染色体畸变试验结果
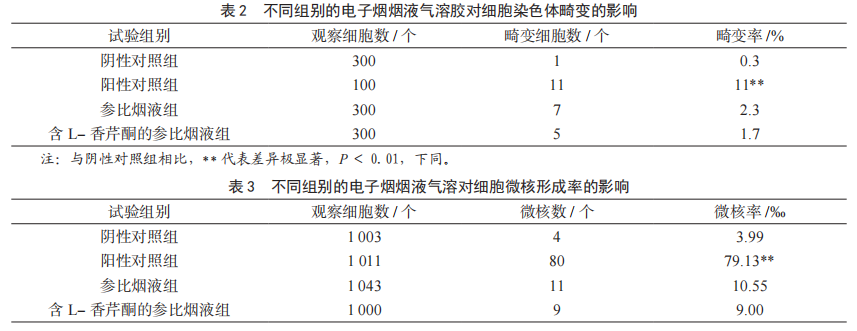
由表2可知,与阴性对照组比较,阳性对照组(丝裂霉素处理)的染色体畸变细胞率明显升高,畸变率具有极显著的统计学差异(<0.01),证明本实验系统有效。但与阴性对照组比较,参比烟液气溶胶组和含L-香芹酮参比烟液气溶胶组染色体畸变率分别为2.3%和1.7%,无显著性差异。同时与参比烟液气溶胶组相比,加入L-香芹酮后雾化剂参比烟液气溶胶的染色体畸变率降低0.6%。
2.3 体外微核试验结果
由表3可知,与阴性对照组比较,阳性对照组(丝裂霉素处理)的总微核率明显升高,具有极显著差异(<0.01),证明本实验系统有效。与阴性对照组比较,参比烟液气溶胶组和含L-香芹酮的参比烟液气溶胶组微核率分别为10.55‰和9.00‰,差异不明显。与参比烟液气溶胶组相比,加入L-香芹酮后雾化剂参比烟液气溶胶微核率降低1.55‰。
3讨论
细菌回复突变试验作为致突变物的早期筛选和前期研究阶段手段,主要利用营养缺陷型菌株,在选择培养基上经外源性物质处理后,观察菌株的回复突变情况,用来判断致突变能力,是科研机构和政府公认的测定新化学物质和新药潜在致突变性的检测方法[13]。对于电子烟遗传毒性的评价,将电子烟气溶胶整体看作外源性混合物,可以通过细菌回复突变试验检测电子烟气溶胶引起的碱基水平上的致突变作用[14]。同时,由于电子烟的特殊使用方式,AZZOPARDI等[15]认为气-液界面暴露的方式进行遗传毒性检测较为科学,可用于检测吸入制品的安全性评价。雾化体中的单一添加剂的安全性,不仅要考虑物质本身的遗传毒性,还应考虑单一添加剂与其他物质的交互作用。
关于L-香芹酮的经口毒性,PROGRAM等[16]在对B6C3F1小鼠每周给药5 d,剂量为375 mg·kg-1或750 mg·kg-1,连续2年进行重复灌胃染毒,未发现L-香芹酮对B6C3F1小鼠具有致癌活性。但吸入途径的遗传毒性还未见报道。因此,本次研究基于上述考虑,采用了气-液(琼脂)界面的暴露方式,测试添加L-香芹酮后对参比烟液气溶胶整体遗传毒性的影响。
电子烟气溶胶的遗传毒性已有较多文献报道,THORNE等[17]研究发现在长达112.5 min的未稀释电子烟气溶胶暴露后,菌株均未发现致突变现象,认为电子烟气溶胶致细菌回复突变能力较弱。这与本实验中参比烟液气溶胶未引起TA97a、TA98、TA100和TA102等4种菌株回复突变的结果较为类似,但本试验中TA1535菌株在有、无代谢活化系统的情况下,雾化剂参比烟液气溶胶和含L-香芹酮的参比烟液气溶胶均发生了致突变效应,这可能是由于参比烟液气溶胶杀死了大部分TA1535细菌,使残存的细菌得以利用培养基中微量的组氨酸和生物素生长成肉眼可见的菌落,但这并非是回复突变菌落,而是由烟液气溶胶毒性导致的假阳性结果[18]。同时,与阴性对照组相比,添加L-香芹酮后也未引起致突变菌落数目的明显增加,说明L-香芹酮不具有增加参比烟液气溶胶的潜在致突变能力。
在染色体畸变试验和微核试验中,与参比烟液组相比,未发现添加L-香芹酮后的烟液气溶胶引起染色体畸变率和微核率的上升,不存在导致细胞染色体畸变和微核突变潜在能力。与阴性对照组相比,参比烟液气溶胶引起的染色体畸变或微核形成率上升不明显,这与MANOJ等[19]和GANAPATHY等[20]的研究结果较为一致。因此,添加L-香芹酮的参比烟液气溶胶对染色体复制和细胞分裂过程的影响较小,未见明显的遗传毒性效应。根据遗传组合试验判断规则[21],添加300 mg·L-1的L-香芹酮不会增加参比烟液气溶胶的遗传毒性。
雾化气溶胶的遗传毒性一直是关注的热点,现在针对气溶胶的遗传毒性大多数采用气-液界面暴露方式[22],但关于雾化添加剂的遗传毒性的评价还很欠缺。有文献单独考察了单一添加剂的遗传毒性[16],但雾化气溶胶的成分较为复杂,检测遗传毒性时应考虑添加剂之间的相互作用。本文采取参比烟液气溶胶作为本底,考察了单一添加剂L-香芹酮添加后整体烟液的遗传毒性,为雾化添加剂的遗传毒性评价提供了一个新的思路。本试验还存在一些缺陷,如仅考虑了L-香芹酮的3倍使用剂量的遗传毒性,暴露时间受雾化设备的限制也仅设置了
30 min,可进一步研究高剂量或者长时间暴露条件下的L-香芹酮的遗传毒性。
4结论
本试验条件下,采取气-液(琼脂)界面暴露,加入300 mg·L-1的L-香芹酮暴露30 min后,未改变雾化剂参比烟液气溶胶的遗传毒性。可见L-香芹酮在限定剂量下其吸入途径的遗传毒性风险较小。
热点推荐
-

主要食品配料厂商携手支持可持续农业
-

别样肉客在华推出脆香酥炸植物基蟹饼,为新春佳节增添美食新选
-

ADM首度亮相FBIF2023,探索食品饮料的今天、明天和未来
-

专访婴儿水团体标准制定者:为何为婴儿饮用水制定更高标准?
-

使用梅特勒-托利多X光机的五大理由
-

百威中国携手合作伙伴打造行业首家碳中和麦芽工厂,再攀减碳高峰
-

首届漯河市酱酒文化节举行
-

三养泰式咖喱蟹味火鸡面惊艳上市
-

全面升级,规模扩容,博华深圳联展12月再临鹏城
-
200朵“小蓝花”绽放,特殊医学用途配方食品行业稳步发展
-

在中国国际肉类工业展览会评鉴来自瑞士的高品质肉类产品
-

选品旺季来袭,2024上海秋季全食展开幕人气破新高!
-

新希望美好食品新品首发山姆,蒜泥白肉复刻经典川味
-

实力摘星!新良一举斩获9项全球性大奖!
-

营养专家力荐雀巢绝对深黑、金牌黑咖啡,为健康生活添动力
-

蒙牛瑞哺恩再度亮剑,震撼发布专利亲和配方临床实证成果!
-

蒙牛一米八八携手中国学生营养日,共筑儿童成长新高度
-

“市场监管听我讲” 力“补短板强弱项”
-

21年寻菌之路,解锁国人好体质科拓生物2024年中国菌发布会圆满落幕
-

ESG催生全球环保包装风潮,swop2024 “双碳新时代”引领可持续发展
-

帝斯曼-芬美意启航一周年 以协同创新推动绿色增长
-

春日消费火热,雀巢推星巴克家享新品满足消费者多元需求
-
恒天然旗下NZMP碳足迹计算工具上线
-

走进梦龙“灯塔工厂”:探秘冰淇淋高质量“智造”之路
-

雀巢咖啡全面焕新:新形象、新产品卷起本土新体验
-

喜报!蜀海荣膺“2024年度餐饮供应链百强企业”
-

ADM发布2024年风味与色彩趋势,展示消费者大胆偏好
-

联合利华饮食策划校企合作联席会议成功举行
-

第八届中国特殊食品大会开幕式暨特殊食品产业T20成功举办
-

金益博第22届订货会暨零食疆山战略发布会圆满举办





