超高效液相色谱-串联质谱法同时测定小麦中4种真菌毒素
2021-10-12 13:58:27 来源: 食品安全导刊
超高效液相色谱-串联质谱法同时测定小麦中
4种真菌毒素
胡 莎1,袁 梦1,葛文静1,林翠苹2,于业志3
(1.青岛市粮油质量检测和军队粮油供应中心,山东青岛 266000;2.青岛市食品药品检验研究院,山东青岛 266000;
3.青岛菲优特检测有限公司,山东青岛 266000)
作者简介:胡莎(1988—),女,江西进贤人,硕士,工程师。研究方向:粮油检测。
作者简介:胡莎(1988—),女,江西进贤人,硕士,工程师。研究方向:粮油检测。
摘 要:本文旨在建立同时测定小麦中脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、黄曲霉毒素B1和赭曲霉毒素A 4种真菌毒素的超高效液相色谱-串联质谱的分析方法。以小麦为研究对象,分样制粉后,经乙腈/水振荡提取后过滤,滤液中加入乙酸混匀,通过MycoSpinTM400多功能净化柱,以1%乙酸溶液+5 mmol/L乙酸铵水溶液-甲醇为流动相,多反应监测模式上机检测。结果显示,4种真菌毒素在各自的浓度范围内均有良好的线性关系(r2≥0.996 2),3水平加标回收率在86.6%~110.1%,相对标准偏差在3.0%~18.7%,具有良好的精密度。该方法具有灵敏度高、准确、高效的优点,适用于小麦中4种真菌毒素同时前处理检测。
关键词:超高效液相色谱-串联质谱;小麦;真菌毒素
真菌毒素污染是威胁粮食安全的重要因素,粮食在种植、加工、储存及流通等环节中可能被真菌毒素污染[1],最新发布的《食品安全国家标准 食品中真菌毒素限量》(GB 2761—2017)规定了谷物及其制品中对黄曲霉毒素B1(Aflatoxin B1,AFT B1)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)、赭曲霉毒素A(Orchatoxin A,OTA)及玉米赤霉烯酮(Zearalenone,ZEN)的限量指标[2-3],这4种真菌毒素是目前为止认为可能对人们的健康构成较大风险的[3-7]。现在国内外对粮油产品中真菌毒素的检测标准方法一般常见的有胶体金快速检测法[8-9]、薄层色谱法[10]、酶联免疫法[11]、高效液相色谱法[12]及液相液质联用法[13]。
本文旨在建立多功能柱净化、超高效液相色谱-串联质谱法同时测定小麦中DON、OTA、AFT B1和ZEN共4种真菌毒素的含量。
1 材料与方法
1.1 仪器与试剂
Agilent超高效液相色谱串联质谱联用仪(UPLC-QQQ 1290-6460,安捷伦科技有限公司);离心机(Sartorius sigma 3-18k)振荡器(Heidolph Multi Reax);电子天平(Sartorius);MycoSpinTM 400 Multitoxin净化柱(Romer Labs公司);微型聚四氟乙烯滤膜(0.22 μm)。
超纯水(娃哈哈);乙腈(色谱纯)、乙酸(色谱纯)、乙酸铵(色谱纯)、甲醇(色谱纯),德国merck公司;标准溶液DON(100.6 mg/L)、ZEN(100.4 mg/L)、AFT B1(100.3 mg/L)、OTA(100.1 mg/L),Pribolab公司。
1.2 实验方法
1.2.1 样品处理
称取25 g(精确至0.001 g)样品于250 mL具塞三角瓶中,加入100 mL乙腈/水(50/50,V/V),放置于震荡器中混合90 min,静置1 min后过滤,吸取10 mL滤液于50 mL聚丙烯离心管中,并加入500 μL乙酸混匀,从混合液中移取750 μL至MycoSpinTM 400净化柱,盖紧净化柱振荡混合
1 min,净化柱底端将净化柱放入离心管中,转速10 000 r/min离心30 s,取上清液过0.22 μm滤膜于进样瓶中,待上机检测。
1.2.2 溶液的配制
(1)混合标准工作液的配制。将4种真菌毒素标准溶液依次稀释成DON(100 μg/mL)、ZEN(100 μg/mL)、
AFT B1(4.0 μg/mL)、OTA(2 μg/mL)的单标储备液,分别吸取1 500 μL、200 μL、250 μL、1 000 μL的DON、ZEN、OTA、AFT B1单标储备液于10 mL容量瓶中,用水定容至刻度,配制成浓度分别为15.0 μg/mL、2.0 μg/mL、0.1 μg/mL、0.2 μg/mL的混合标准工作液。
(2)标准溶液配制。分别准确移取25 μL、50 μL、
100 μL、250 μL、500 μL和1 000 μL混标溶液于10 mL容量瓶中,用标准曲线溶剂(乙腈-水-乙酸混合液35.0︰64.5︰0.5,体积比)定容至刻度,各标准具体浓度见表1。
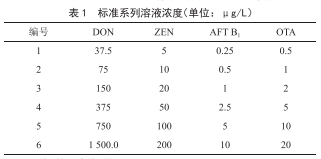
1.2.3 色谱分离条件
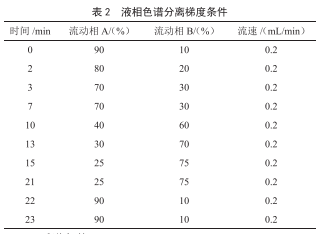
色谱柱C18柱(1.8 μm,100 mm×3.0 mm);柱温:35 ℃;进样体积:4 μL;流动相A:1%乙酸溶液+5 mmol/L乙酸铵水溶液;流动相B:甲醇,流动相梯度见表2。
1.2.4 质谱条件
离子源:电喷雾离子源;毛细管电压:4 kV(+)3.5 kV(-);干燥气温度:350 ℃;雾化气电压:40 psi;干燥气流量:10 L/min;碰撞气:氮气;扫描模式:多反应监测MRM;驻留时间:30 ms;
2 结果与分析
2.1 液相色谱条件的优化
2.1.1 流动相的优化
流动相对检出目标物质的分离度、响应值、峰型及离子化效率都有影响,根据现有的检测这4种毒素的检测标准及相关文献显示流动相一般采用甲酸水溶液/乙腈,乙腈/乙酸铵,乙腈/甲酸/甲酸铵,乙腈/水,乙酸铵/甲醇-乙腈,结合需检出的这4种真菌毒素的结构特性,一般在ESI正负离子模式下[M+H]+、[M-H]-、[M-CH3COO]-、[M+NH4]+离子峰形式出现,本实验选定流动相为1%乙酸溶液+5 mmol/L乙酸铵水溶液/甲醇对4种真菌毒素能够有很好的分离效果。
2.1.2 色谱柱的优化
本实验比较了两种色谱柱Eclispse Plus C18(2.1mm×50 mm,1.8 μm)和ZORBAX Eclipse Plus C18(3.0 mm×100 mm,1.8 μm)对4种真菌毒素的分离效果,同样的色谱条件下后一种色谱柱分离效果更佳。
2.2 质谱条件的优化
2.2.1 母离子的选择和碎裂电压的优化
将真菌毒素单标溶液直接连接质谱进样1 μL,分别在正负离子模式下进行MS2 Scan全扫描,确定各毒素母离子质量数。然后进行MS2 SIM选择离子监测,优化碎裂
电压。
2.2.2 子离子的选择和碰撞能量的优化
设置母离子质量数和MS2的扫描范围,进行Product Ion Scan 子离子扫描,将响应最高的确定为定量离子,次之确定为定性离子,并优化碰撞能量CE。优化完成后进行MRM多反应监测,主要参数见表3。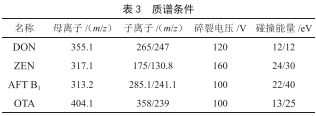

2.3 线性范围与检出限
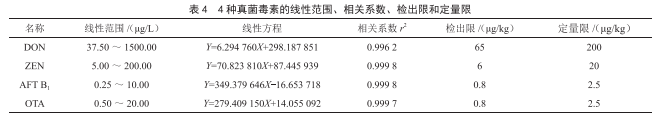
由表4可知,4种真菌毒素在标准曲线溶液浓度范围内有较好的线性关系,以3倍和10倍信噪比分别确定目标物的检出限和定量限。
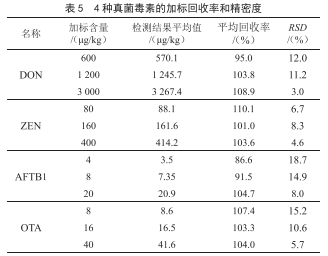
2.4 回收率与精密度
在空白样品中添加低、中、高3个不同浓度的混合标准溶液,3水平重复测定6次,加标回收率、相对标准偏差结果见表5。3水平加标回收率在86.6%~110.1%,相对标准偏差在3.0%~18.7%,由此可见,方法具有良好的精
密度。

3 结论
本文采用乙腈水提取小麦中4种常见真菌毒素,MycoSpinTM400 Multitoxin 净化柱净化,能有效的去除小麦基质中的杂质,减少基质效应,采用三重四极杆液质联用MRM模式进行检测,该方法高效快捷、操作简单、回收率高,精密度与准确度好,适合同时测定小麦中4种真菌
毒素。
参考文献
[1]苏福荣,王松雪,孙辉,等.国内外粮食中真菌毒素限量标准制定的现状与分析[J].粮油食品科技,2007,15(6):57-59.
[2]国家卫生和计划生育委员会,国家食品药品监督管理总局.食品中真菌毒素限量:GB 2761—2017[S].北京:中国标准出版社,2017.
[3]DRAGAN R M,MARIJA Š,TATJANA B.Real and perceived risks for mycotoxin contamination in foods and feeds:challenges for food safety control[J].Toxins,2010,2(4):572-592.
[4]BLAKE R R,MUSTAFA I S.Aflatoxin B1:A review on metabolism,toxicity,occurrence in food,occupational exposure, and detoxification methods[J].Food and Chemical Toxicology,2018,124:81-100.
[5]ANNIE P,RICHARD A M.Ochratoxin A:An overview on toxicity and carcinogenicity in animals and humans[J].Molecular Nutrition and Food Research,2007,51(9):1192.
[6]JAMES J P.Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J].Archives of Toxicology,2010,84(9):663-679.
[7]KAROLINA K,DOMINIKA E,AGNIESZKA W.Zearalenone as an endocrine disruptor in humans[J].Environmental Toxicology and Pharmacology,2016,48:141-149.
[8]曹德康,苏建忠,张瑛,等.胶体金免疫层析技术快速检测谷物中3种真菌毒素的研究[J].中国食品卫生杂志,2017,29(3):306-312.
[9]陈明伟,王岩,张永君,等.粮食中真菌毒素和快速定量检测方法的探讨[J].粮食与食品工业,2020,27(4):69-71.
[10]冯莉.薄层色谱法检测玉米中黄曲霉毒素B1[J].现代畜牧科技,2018(8):24.
[11]刘菲,王莉娜,胡俊.酶联免疫吸附筛法测定大米和大麦中黄曲霉毒素B1的含量[J].2018,6(69):14-18.
[12]BASCARÁN V,ROJAS D,CHOUCIÑO P,et al.Analysis of ochratoxin A in milk after direct immunoaffinity column clean-up by high-performance liquid chromatograp-by with fluorescence detection[J].Journal of chromatography A,2007,1167(1):95-101.
[13]朱芸,雒婉霞,赵清荣,等.液质联用同位素内标法同时测定3类小麦终产品中4种B类单端孢烯霉族类真菌毒素[J].中国卫生检验杂志,2017,27(13):1863-1866.
热点推荐
-

主要食品配料厂商携手支持可持续农业
-

别样肉客在华推出脆香酥炸植物基蟹饼,为新春佳节增添美食新选
-

ADM首度亮相FBIF2023,探索食品饮料的今天、明天和未来
-

专访婴儿水团体标准制定者:为何为婴儿饮用水制定更高标准?
-

使用梅特勒-托利多X光机的五大理由
-

广西发动全区3·15食品安全“你点我检 服务惠民生”问卷调查
-

河南全省食品安全监管工作会议在鹤壁召开
-

万里挑一的“进博TOP好物”,三养创新产品与食安承诺受赞誉
-

河南省餐饮食品安全“总监话总监”巡讲活动在洛阳启动
-

郑州市举办2024年“质量月”质量诚信进商超暨质量提升交流观摩会
-

仁和中方医药股份联合民生大药房送健康捐赠活动在郑州举行
-

三养密阳工厂深度揭秘:火鸡面的食品安全与品质卓越之道
-

郑州市金水区召开学校食堂承包经营企业 食品安全行政指导会
-

陕西省举办全省学校食堂食品安全管理及投诉处置现场会
-

山西省局举办质量提升行动助力汾酒专业镇高质量发展活动
-

郑州市金水区开展肉类产品质量安全专项整治
-

郑州市市场监管局开展网络餐饮服务食品安全行政指导工作
-

西藏山南市率先将“两个责任”进党校 推动食品安全社会共治
-

湖北:开展校园食品安全和“五一” 期间食品安全监管工作
-

河南省政府食品安全办召开2024年夏季食品安全形势会商会议
-

山西省局召开食品安全抽检承检机构任务部署会
-

南昌市开展春节前食品经营安全监督检查
-

河南省汝南县:“你点我检服务惠民生”护航“双节”食品安全
-

湖北省局推动共建“外卖小哥食堂” 让外卖骑手暖心又暖胃
-

焦作市校园食品安全排查整治专项行动动员部署会召开
-

汝南县市场监管局“四个抓手”提升集中用餐单位食品安全水平
-

山西省市场监管局食品案件查办指导中心正式挂牌运行
-

河南省汝南县市场监管局多措并举开展学校食堂食品安全评价
-

恩施州市场监管局服务第八届世界硒博会
-

开封市市场监管局2023年食品抽检工作质量提升推进会召开





