一种氯霉素高灵敏消线法检测试纸条的制备
2021-08-20 23:08:20 来源:
一种氯霉素高灵敏消线法检测试纸条的制备
宁军1,李 娜 2、严雨倩2,付 麟2,周兴华2
(1.广东精捷检验检测有限公司,广东云浮 527400;2.江苏大学食品与生物工程学院,江苏镇江 212013)
摘 要∶本文对氯霉素进行丁二酸酐衍生得到半抗原,将半抗原与载体蛋白 BSA偶联作为免疫原,氯霉素与偶连载体蛋白 0VA作为筛选抗原,获得氯霉素单克隆抗体,IC。值为0.010 6 ng/mL,线性范围为 0.002 3~0.0495 ng/mL,特异性好,与相关药物没有交叉。在此抗原抗体的基础上制备胶体金试纸条,对鸡肉样本进行添加回收试验,消线法检测限为0.1μg/kg,与目前市场上主流的比色法判读试纸条相比,消线法判读更加快速,不需要使用读数仪辅助判读,为农产品质量安全提供有力保障。
关键词∶氯霉素;单克隆抗体;胶体金免疫层析试纸条;消线法;检测
氯霉素(Chloramphenicol, CAP)是一种广谱抗生素,对 革兰氏阴性菌和革兰氏阳性菌均有抑制作用。长期食用含有 氯霉素的鸡肉组织会扰乱人体正常的生理功能,引起再生障 碍性贫血。农业部第250号公告中明确规定氯霉素及其盐、 酯在动物性食品中禁止使用,所以测定动物组织中氯霉素残 留含量具有重要的意义。目前动物性食品中氯霉素残留检测 方法有免疫分析方法、质谱法等。免疫学方法是农产品中抗 生素残留检测中最重要的检测技术之一,具有成本低、操作 简便、快速等优点,不需要辅助仪器,更适合大量样本的初 筛检测。目前市场上的氯霉素试纸条,灵敏度不够高,基本 上都是釆用比色判读方法,试纸条上控制线和检测线差异不 大,判读结果争议较大。本研究制备的氯霉素试纸条,灵敏 度高,可以釆用消线法判读,判读更加快速、准确,为农产 品质量安全提供有力保障『%
1材料与方法
1.1试剂与药品
氯霉素标准品,购买自百灵威科技有限公司;牛血清白 蛋白(BSA)、水溶性碳二亚胺盐酸盐(EDC HCL)、N-羟 基琥珀酰亚胺(NHS)、3,3',5,5,-四甲基联苯胺(TMB)、 弗氏完全佐剂、弗氏不完全佐剂、聚乙二醇溶液(50% PEG solution(w/v))、辣根过氧化酶(HRP)标记的羊抗鼠二抗、 羊抗鼠抗体IgG购买自武汉博士德公司;新西兰胎牛血清, 细胞基础培养液RPMI 1640,选择性培养基HAT(50x)、 HT(100x),购买自Gibco公司;胶体金试纸条底板(PVC 材质),硝酸纤维素膜(NC膜),吸水垫和样品垫均购买 自Goldbio科技有限公司;其他实验室常用试剂均为国产分 析纯,购自上海国药集团化学试剂有限公司;阴性鸡肉样本 由温氏集团检测中心提供。
1.2仪器与设备
台式高速(冷冻)离心机,湘仪仪器;高压蒸汽灭菌锅 (MLS-375 1L-PC),松下健康医疗器械株式会社;磁力搅 拌器(Big Squid),德国IKA;纯水机(20 TB),赛飞(中国) 有限公司;液氮罐,成都金凤液氮容器有限公司;酶标仪、 3111型加水套CO2培养箱、紫外-可见分光光度计Biomate 3S, Thermo Fisher Sciencetific 公司洁净工作台(BCM-1300A), 苏净安泰空气技术有限公司;数显恒温水浴锅(HH-2),江 苏金怡仪器科技有限公司;倒置显微镜(XD-202),南京江 南永新光学有限公司;金标滑膜仪、切条机,上海金标生物 科技有限公司。
1.3实验动物和细胞
实验动物:SPF级BALB/c小鼠,6 ~ 8周龄,雌性, 扬州大学医学中心;实验细胞:SP 2/0细胞,中国科学院上 海生命科学研究院。
1.4试验方法
1.4.1半抗原衍生
氯霉素分子表面有两个自由羟基,一个伯羟基,一个仲 羟基。伯羟基可以与丁二酸酊反应生成梭酸,可与蛋白偶连。 5.5 mg氯霉素溶解于0.5mLtt®中,加入4.2mgDMAP 与2 mg 丁二酸酊,50P磁力搅拌反应4h,得到衍生产物 CAP-COOH.将反应产物氮吹干,溶解于水中并使用二氯 甲烷萃取2次,将二氯甲烷相合并,氮气吹干,得到目标产 物旷71。衍生步骤如图1所示。
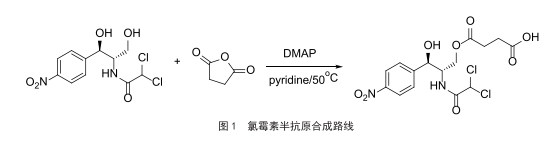
1.4.2完全抗原的合成
(1) 免疫原合成方法。2 mg的CAP-COOH半抗原溶解 于400 hL DMF溶液中,加入1.1 mg NHS与1.8 mg碳二亚 胺EDC,室温条件下磁力搅拌反应2 h,得到活性酯。随后 将活性酯逐滴加到5 mg BSA溶液中,室温磁力搅拌过夜。 将最终产物装入透析袋中,在0.05 mol/L PBS溶液中透析 3d,每4〜8h更换一次透析液。透析结束后分装小份, -20 °C保存[8_10]o
(2) 包被原合成方法。氯霉素上游离的羟基通过CDI法 与蛋白偶联,3 mg CAP溶解于0.5 mL无水DMSO试剂中, 加入2mgCDL室温磁力搅拌反应20 min。向反应液中加 入100 uL超纯水终止反应。随后将活化产物逐滴加到5 mg OVA蛋白溶液,室温条件下磁力搅拌反应4 h。偶联产物在 0.05 mol/L PBS溶液中透析3d,每4〜8h更换一次透析 液凹。透析结束后分装小份,-20 P保存。
1.4.3小鼠免疫及血清筛选
使用合成的完全抗原CAP-COOH-EDC-BSA作为免疫 原进行小鼠免疫实验,CAP-CDI-OVA作为包被原进行筛选 实验。每个免疫原选取4 H BALB/c小鼠进行免疫。釆用间 接竞争ELISA方法[12-13]测定小鼠血清效价与抑制效果,具 体步骤如下。
(1) 包板。用包被缓冲液将包被原(CAP-CDI-OVA)稀释 到适宜浓度,加入到96孔酶标板(100 J1L/孔)中,37。(2下 孵育2h。孵育结束后甩出酶标板中液体,加入洗涤缓冲液 (含 0.05% 吐温 20 的 0.01 mol/L PBS, 200 gL/ 孔),静止 3 min后甩出,拍干,重复洗涤3次,拍干。
(2) 封闭。每孔中加入200 gL封闭液,4。(3过夜,洗涤 液改为250pL洗涤3次,拍干。
(3) -抗。使用棋盘法同时测定小鼠的血清效价与抑 制。使用洗涤缓冲液作为阴性对照(50 nL/孔),检测组加 入适宜浓度的标准品溶液(50 jxL/孔)。处理好的小鼠血清从 1 000倍用抗体稀释液进行梯度稀释(1 000> 3 000> 9 000> 27 000倍),分别对应加入对照组与检测组中,37P下孵 育30tnm,洗涤3次同上,拍干。
(4) 二抗。将HRP二抗用洗涤缓冲液稀释3 000倍,然 后每孔加入100 gL,37 °C下反应30 min,洗涤3次同上,拍干。
(5) 显色。使用前将A液与B液按1 : 1配制,混匀后 加入酶标板(100 pL/孔),37 °C下避光显色15 min。
(6) 终止。酶标板中每孔加入50 nL终止液,使用酶标 仪测量450 nm、620 nm下吸光值,最终结果按照OD颂皿- OD620mn保存数据。
1.4.4细胞融合及抗体制备
筛选效果较好的小鼠进行细胞融合试验。①SP 2/0细胞 的复苏与扩大培养;②小鼠脾脏细胞融合。小鼠脾细胞与 SP2/0细胞混合均匀,比例为5 : 1,釆用PEG 1500进行 细胞融合试验;③杂交瘤细胞的培养与筛选。细胞融合后第 7 d进行细胞上清检测,挑选OD值高,抑制率高的孔进行 亚克隆,使用有限稀释法进行3次亚克隆,挑选出单团杂交 瘤细胞转移至培养瓶中进行扩大培养,最后转移至液氮储存 箱中保存叫
釆取体内诱生腹水瘤法制备细胞株腹水抗体,再使用辛 酸-硫酸铉法进行抗体纯化[11]=
1.4.5单克隆抗体的评价
釆用间接竞争法,分别测定所制备单克隆抗体对氯霉素 与其结构类似物(氟苯尼考、甲砚霉素)的值。交叉反 应率(Cross-reactivity, CR, %)=(氯霉素 /C50 值 / 类似物
值)xi00%[6113]o
1.4.6胶体金试纸条的制备
按照柠檬酸三钠还原法制备金纳米粒子,釆用O.lmol/L 碳酸钾溶液进行抗体标记,标记量分别为6 pg/mL、8 gg/mL, 10 p.g/mL 和 12 pg/mL, 10% BSA 封闭,0.01 mol/L pH 8.5 硼酸缓冲液(含0.25% BSA, 3%海藻糖,1%吐温20)复溶, 按照50 nL每孔加入到微孔板中,冻干,密封保存。
试纸条主要由PVC底板,NC膜,样品垫和吸水纸组成。 将羊抗鼠抗体(靠吸水纸端)和抗原(靠样品垫端)按照一定的 浓度划到硝酸纤维膜上,分别构成试纸条质控线(C线)和检 测线(T线),随后将试纸条在37P下烘箱中烘干过夜us, 在靠近C端贴上吸水纸,靠近T线端贴好样品垫。切成4 mm 宽度。检测时,将待检测液体加入微孔中,反应3 min后, 插入试纸条,5mhi后判读。
1.4.7添加回收试验
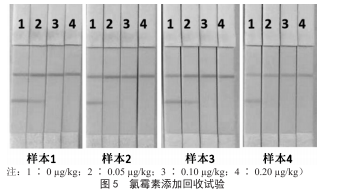
对鸡肉阴性样本进行氯霉素添加回收试验。阴性对照组 添加不含标准品空白溶剂作为对照。具体操作如下:取4g 均质后的样品,添标浓度分别为0、0.05 pg/kg、0.10 gg/kg 和0.20 gg/kg,加入7 mL乙酸乙酯,剧烈振荡5 min, 4 000转离心5 min。取4mL上清,氮气65。(3吹干后,再 加入2 mL正己烷和0.4 mL 0.01 mol/L PBS,振荡1 min,离 心3 min,去除上层,取下层溶液100 gL点样。
2结果与分析
2.1完全抗原的合成与表征
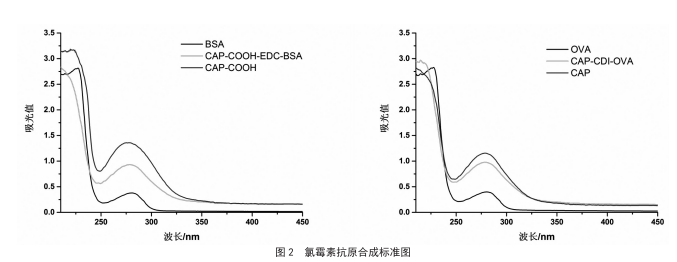
氯霉素半抗原、载体蛋白(BSA和OVA)及合成的免疫 抗原和包被抗原分别使用0.01 moVL PBS稀释至合适的浓 度,使用紫外-可见分光光度计在200〜450 nm范围内进 行扫描,结果如图2所示。
如图2所示,两种载体蛋白的紫外特征峰均位于278 nm 左右,偶联物CAP-COOH-EDC-BSA紫外吸收较同浓度的 BSA有明显增强且有略微偏移。同样,偶联物CAP-CDI- OVA紫外吸收较同浓度OVA也有明显增强,紫外表征结果 显示氯霉素半抗原成功的与载体蛋白进行了偶联。
2.2单克隆抗体的评价
通过对小鼠血清进行ELISA检测,筛选效价高、抑制 率高的小鼠进行细胞融合实验。通过阳性筛选与3次亚克隆, 得到针对氯霉素的杂交瘤细胞株(6E2),并制取腹水,纯 化后得到氯霉素单克隆抗体[11]
釆用棋盘法,筛选出氯霉素单克隆抗体的最佳工作点, 即包被浓度0.03卩g/mL、抗体浓度0.25卩g/mL,然后以不同 浓度的氯霉素标准品溶液(0、0.003 ng/mL、0.010 ng/mL、 0.030 ng/mL、0.090 ng/mL 和 0.270 ng/mL)建立标准曲线, 其标准曲线如图3所示,其云爲值为0.010 6 ng/mL,线性 范围CIG。〜IC80)为0.002 3〜0.049 5 ng/mL,相关系数 为 0.999 Oo

通过ic-ELISA方法测定氯霉素单克隆抗体的交叉反应, 检测结果如表1所示,氯霉素单克隆抗体具有特异性,对氟 苯尼考和甲飒霉素交叉均在1%以下。

2.3胶体金试纸条的制备
使用不同包被浓度和抗体标记量进行试验,确定最优条 件C线划膜浓度为0.5 mg/mL、T线划膜浓度为0.2 ing/mL 和抗体标记量为10|ig/mL。如图4所示,使用肉眼观察时, 氯霉素金标试纸条消线值为0.1卩g/kg。

2.4实际样本添加回收试验
采用以上前处理方法,使用阴性样品添加试验确定该 方法灵敏度。4种阴性鸡肉样品氯霉素添加水平为0、0.05g/kg、0.10μg/kg、0.20 μg/kg。结果如图5所示,使用肉
眼观察时,氯霉素消线法的检测限为0.1 μg/kg。
3 结论
本文采用一种完全抗原对小鼠进行免疫,成功制备了一种氯霉素单克隆抗体,ICso值为0.0106ng/mL,特异性好,与相关药物没有交叉。在此抗原抗体的基础上制备胶体金试纸条,对鸡肉组织样本做了添加回收试验,消线法检测限为0.1 μg/kg,该方法成本低、灵敏度好、操作方便快速,判读方式简单,对鸡肉中氯霉素残留的监控有重要意义。
参考文献
王安伟,刘天密,覃锐,等.水产品中氯霉素残留检测方法研究进展[J],食品安全质量检测学报,2017,8(11):42594264.
[2]蔡梦迪,蔡波,郑添裕.食品中残留氯霉素的检测方法 研究[J].科技风,2015(12):138-139.
[3]蒋定国,杨大进.动物性食品中氯霉素残留检测技术的 研究概况(综述)[J],中国食品卫生杂志,2002,14(2):44-47.
[4]李晓川,孔轶群,冷凯良,等.水产品中氯霉素残留测 定方法的分析研究[J],渔业科学进展>2002,23(4):76-81.
[5]赵文亚,沈美芳,徐幸莲,等.气相色谱法测定水产品 中氯霉素残留[J].水产学报,200327(3):278-282.
[6]覃雅丽,石德时,王桂枝,等.抗氯霉素单克隆抗体的 制备及鉴定[J],中国兽医学报,2001(6):556-558.
[7]方伟,姜有声,黄宣运,等.氯霉素单克隆抗体的研制 及其特性分析[C]//全国水产青年学术年会.2009.
[8]XU NjXU L,MA Wet aLDevelopment and characterisation of an ultrasensitive monoclonal antibody for chloramphenicol[J].Food Agricultural Immunolog^2015^6(3):440-450.
[9]LIU C,DENG D,XU D,et al.Development of a monoclonal antibody based-ELISA for the detection of chloramphenicol in shrimp,feed and milk samples and validation by LC-MS/ MS coupled with immuno affinity clean-up[ J] .Analytical Methods^019,l 1(4):507-516.
[10]何佳琪,段振娟,张燕,等.氯霉素残留ELISA检测 方法[J],中国兽医杂志>2008,44(2):88-89.
[11]孔德昭.食品中真菌毒素抗体制备及其快速检测方法 研究[D],无锡:江南大学,2017:1.
[12]徐修远.氯霉素抗体的制备与间接竞争ELISA检测 氯霉素残留的初步研究[D],沈阳:沈阳农业大学,2004.
[13]蒋永青,朱永利,王甜甜,等.氯霉素抗体的制备及其 免疫分析方法研究进展[J].广东化工,2017,44(22):97-98.
[14]孔令文.氯霉素侧流层析免疫检测技术研究[D],舟山: 浙江海洋学院2012.
[15]王玮.氯霉素残留快速检测胶体金试纸,条的研究[D]. 天津:天津科技大学>2008.
[16]李余动,张少恩,吴志刚,等.胶体金免疫层析法快速 检测氯霉素残留[J].中国食品卫生杂志,2005,17(5):416419.
热点推荐
-

主要食品配料厂商携手支持可持续农业
-

别样肉客在华推出脆香酥炸植物基蟹饼,为新春佳节增添美食新选
-

ADM首度亮相FBIF2023,探索食品饮料的今天、明天和未来
-

专访婴儿水团体标准制定者:为何为婴儿饮用水制定更高标准?
-

使用梅特勒-托利多X光机的五大理由
-

广西发动全区3·15食品安全“你点我检 服务惠民生”问卷调查
-

河南全省食品安全监管工作会议在鹤壁召开
-

万里挑一的“进博TOP好物”,三养创新产品与食安承诺受赞誉
-

河南省餐饮食品安全“总监话总监”巡讲活动在洛阳启动
-

郑州市举办2024年“质量月”质量诚信进商超暨质量提升交流观摩会
-

仁和中方医药股份联合民生大药房送健康捐赠活动在郑州举行
-

三养密阳工厂深度揭秘:火鸡面的食品安全与品质卓越之道
-

郑州市金水区召开学校食堂承包经营企业 食品安全行政指导会
-

陕西省举办全省学校食堂食品安全管理及投诉处置现场会
-

山西省局举办质量提升行动助力汾酒专业镇高质量发展活动
-

郑州市金水区开展肉类产品质量安全专项整治
-

郑州市市场监管局开展网络餐饮服务食品安全行政指导工作
-

西藏山南市率先将“两个责任”进党校 推动食品安全社会共治
-

湖北:开展校园食品安全和“五一” 期间食品安全监管工作
-

河南省政府食品安全办召开2024年夏季食品安全形势会商会议
-

山西省局召开食品安全抽检承检机构任务部署会
-

南昌市开展春节前食品经营安全监督检查
-

河南省汝南县:“你点我检服务惠民生”护航“双节”食品安全
-

湖北省局推动共建“外卖小哥食堂” 让外卖骑手暖心又暖胃
-

焦作市校园食品安全排查整治专项行动动员部署会召开
-

汝南县市场监管局“四个抓手”提升集中用餐单位食品安全水平
-

山西省市场监管局食品案件查办指导中心正式挂牌运行
-

河南省汝南县市场监管局多措并举开展学校食堂食品安全评价
-

恩施州市场监管局服务第八届世界硒博会
-

开封市市场监管局2023年食品抽检工作质量提升推进会召开





